题目内容
【题目】某实验小组为了测定某氯酸钾样品中氯酸钾的质量分数,取10g样品和1g二氧化锰混合后盛于试管中加热,在不同时间测得试管内固体质量如下表:
时间/分钟 | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
试管中剩余固体质量/g | 11 | 10.6 | 9.0 | 7.8 | 7.16 | 7.16 | m |
回答下列问题:
(1)表中的m=________。
(2)实验中产生的氧气质量是________g。
(3)求该氯酸钾样品中氯酸钾的质量分数为________。写出计算过程(结果精确到1%)。
【答案】7.16 3.84 98%(过程见解析)
【解析】
(1)由表中数据分析可知,从4分钟后固体质量就不再减少,说明氯酸钾已经全部分解,所以第6分钟时固体m的值仍为7.16,故填7.16;
(2)试管中固体减少质量即为产生氧气质量,产生氧气的质量为11g-7.16g=3.84g;(3)根据生成的氧气质量和反应的化学方程式,先求出样品中氯酸钾的质量,再求氯酸钾的质量分数,详细的解题过程如,
解:设样品中氯酸钾的质量为X,
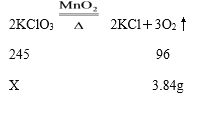
![]() =
=![]()
解得X=9.8g,
该样品中氯酸钾的质量分数为![]() ×100%=98%
×100%=98%
答:该样品中氯酸钾的质量分数为98%。

练习册系列答案
相关题目
【题目】下表是生活饮用水国家标准的部分内容。请回答:
项目 | 限值 |
色度(铂钴色度单位) | 15 |
浑浊度(NTU-散射浊度单位) | 水源与净水技术条件限制时为3 |
臭和味 | 无异臭、异味 |
肉眼可见物 | 无 |
总硬度(以CaCO3计,mg/L) | 450 |
铝(mg/L) | 0.2 |
铁(mg/L) | 0.3 |
(1)上表中的“铁”指的是______(填“单质”“元素”或“原子”)。
(2)生活中软化硬水的方法是______。
(3)实验室用上述水样通电分解该反应的化学方程式是______。
(4)1L合格的生活饮用水中,均以CaCO3计算硬度,则钙元素的含量不超过______mg/L。