题目内容
29、Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH-A↓+NaCl,则A沉淀是
用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀.
方法一:用不含氧气的蒸馏水配置FeSO4溶液与氢氧化钠溶液,然后反应制备.
(1)除去蒸馏水中溶解的氧气,常采用
(2)先在试管中注入FeSO4溶液后,还要在试管中滴入
(3)生成白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
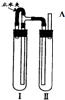
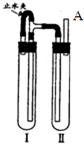
方法二:用如图装置来制备.

(1)在装置Ι中加入Fe和稀H2SO4,写出其反应的化学方程式
(2)在装置Ⅱ中加入NaOH浓溶液.
(3)为了制得白色Fe(OH)2沉淀,在装置Ι和Ⅱ中加入试剂,打开止水夹,塞紧橡胶塞,反应一段时间后再夹紧止水夹,在夹紧止水夹之前的实验步骤是
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其原因是
(5)将18克Fe(OH)2在空气中高温加热到质量不再变化为止,最终得到16克只含有Fe、O元素的剩余固体,请你通过计算来确认该固体的化学式.
[反思与应用]:
(1)在化学实验中对于滴管到底能否伸入容器口内部去滴液体你的看法是
(2)请你提出一个有关化学的常规情况下认为不可以,但改变了条件后却可以打破常规的例子
Fe(OH)3
.由于Fe(OH)2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3
,因而在溶液中较难制得纯净的Fe(OH)2.若按照常规的正确方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀现象,只能看到灰绿色沉淀.你认为灰绿色沉淀最可能的成分是Fe(OH)2和Fe(OH)3的混合物
.用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀.
方法一:用不含氧气的蒸馏水配置FeSO4溶液与氢氧化钠溶液,然后反应制备.
(1)除去蒸馏水中溶解的氧气,常采用
煮沸
的方法.(2)先在试管中注入FeSO4溶液后,还要在试管中滴入
少量植物油
,然后再考虑加入NaOH溶液,实验更容易获得成功.(3)生成白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
防止氧气进入溶液中或防止Fe(OH)2与O2接触
.方法二:用如图装置来制备.

(1)在装置Ι中加入Fe和稀H2SO4,写出其反应的化学方程式
Fe+H2SO4=FeSO4+H2↑
.(2)在装置Ⅱ中加入NaOH浓溶液.
(3)为了制得白色Fe(OH)2沉淀,在装置Ι和Ⅱ中加入试剂,打开止水夹,塞紧橡胶塞,反应一段时间后再夹紧止水夹,在夹紧止水夹之前的实验步骤是
在A处收集氢气进行验纯
,写出夹紧止水夹后Ⅱ中的反应方程式H2SO4+2NaOH=Na2SO4+2H2O
、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
.(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其原因是
隔绝了氧气
.(5)将18克Fe(OH)2在空气中高温加热到质量不再变化为止,最终得到16克只含有Fe、O元素的剩余固体,请你通过计算来确认该固体的化学式.
Fe2O3
[反思与应用]:
(1)在化学实验中对于滴管到底能否伸入容器口内部去滴液体你的看法是
如果是滴瓶上的专用滴管不可以,若是另取的滴管则可以
.(2)请你提出一个有关化学的常规情况下认为不可以,但改变了条件后却可以打破常规的例子
在实验室中鉴别食盐和蔗糖时不能用品尝的方法
在家中的厨房中就可以用品尝的方法来鉴别
.分析:根据在复分解反应中各元素化合价不变交换成分求出A沉淀的化学式,根据方程式的书写方法写方程式,灰绿色沉淀是红褐色沉淀和白色沉淀的混合物所呈现的颜色.
方法一(1)根据气体溶解度与温度的关系来考虑;(2)加入植物油繁殖空气中氧气进入;(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下也是为了防止空气中氧气进入;
方法二(1)根据方程式的书写方法;(3)点燃可燃性气体前要验纯,由于铁与硫酸反应生成了硫酸亚铁,还有没反应的硫酸,加入氢氧化钠后,氢氧化钠与这两种物质都反应;(4)由于与氧气不接触不易被氧化;(5)根据计算出铁元素与氧元素的质量比求出化学式;
方法一(1)根据气体溶解度与温度的关系来考虑;(2)加入植物油繁殖空气中氧气进入;(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下也是为了防止空气中氧气进入;
方法二(1)根据方程式的书写方法;(3)点燃可燃性气体前要验纯,由于铁与硫酸反应生成了硫酸亚铁,还有没反应的硫酸,加入氢氧化钠后,氢氧化钠与这两种物质都反应;(4)由于与氧气不接触不易被氧化;(5)根据计算出铁元素与氧元素的质量比求出化学式;
解答:解:FeCl3和NaOH相互交换成分,化合价不变,生成物为氢氧化铁和氯化钠;根据Fe(OH)2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)3,可推出反应物为Fe(OH)2、水、氧气生成物为Fe(OH)3利用奇偶法配平;由于Fe(OH)2不稳定所以反应生成的氢氧化亚铁很容易被氧化为氢氧化铁红褐色沉淀,结果为灰绿色沉淀是被氧化了的氢氧化铁和没被氧化了的氢氧化亚铁的混合物.
方法一:(1)由于气体的溶解度与温度成反比,所以煮沸即可将水中的氧气除去;
(2)注入植物油防止空气中氧气进入;
(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下也是为了防止空气中氧气进入;
方法二;(1)Fe和稀H2SO4反应生成硫酸亚铁和氢气,已经平了,注意上升符号的标法;
(3)点燃可燃性气体前要验纯,由于铁与硫酸反应生成了硫酸亚铁,还有没反应的硫酸,加入氢氧化钠后,氢氧化钠与这两种物质都反应,根据方程式的写法去写即可;
(4)改装后的装置氧气进不去,所以不容易变质;
(5)由题意可知Fe(OH)2高温后生成铁的氧化物和水,根据水的质量为18g-16g=2g算出氢元素质量,和与氢结合的氧元素质量用总质量一减算出铁的氧化物中铁元素与氧元素的质量比,用铁元素的质量除以铁的相对原子质量,用氧元素的质量除以样的相对原子质量,算出它们的原子个数比,就写出了化学式;如果是滴瓶上的专用滴管不可以,因为做完实验在将滴管放入滴瓶时容易污染试剂,若是另取的滴管则可以因为它需要清洗.在实验室中鉴别食盐和蔗糖时不能用品尝的方法;在家中的厨房中就可以用品尝的方法来鉴别.只要答案合理均可,这是一个开放型题目.
故答案为:
Fe(OH)3;4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe(OH)2和Fe(OH)3的混合物
方法一:(1)煮沸;(2)少量植物油;(3)防止氧气进入溶液中或防止Fe(OH)2与O2接触或其它正确方法
方法二:(1)Fe+H2SO4=FeSO4+H2↑;(3)在A处收集氢气进行验纯
H2SO4+2NaOH=Na2SO4+2H2O;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;
(4)隔绝了氧气;
(5)Fe2O3
反思与应用:(1)如果是滴瓶上的专用滴管不可以,若是另取的滴管则可以
(2)在实验室中鉴别食盐和蔗糖时不能用品尝的方法;在家中的厨房中就可以用品尝的方法来鉴别.答案合理均可
注:若有其它合理答案,均可
方法一:(1)由于气体的溶解度与温度成反比,所以煮沸即可将水中的氧气除去;
(2)注入植物油防止空气中氧气进入;
(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下也是为了防止空气中氧气进入;
方法二;(1)Fe和稀H2SO4反应生成硫酸亚铁和氢气,已经平了,注意上升符号的标法;
(3)点燃可燃性气体前要验纯,由于铁与硫酸反应生成了硫酸亚铁,还有没反应的硫酸,加入氢氧化钠后,氢氧化钠与这两种物质都反应,根据方程式的写法去写即可;
(4)改装后的装置氧气进不去,所以不容易变质;
(5)由题意可知Fe(OH)2高温后生成铁的氧化物和水,根据水的质量为18g-16g=2g算出氢元素质量,和与氢结合的氧元素质量用总质量一减算出铁的氧化物中铁元素与氧元素的质量比,用铁元素的质量除以铁的相对原子质量,用氧元素的质量除以样的相对原子质量,算出它们的原子个数比,就写出了化学式;如果是滴瓶上的专用滴管不可以,因为做完实验在将滴管放入滴瓶时容易污染试剂,若是另取的滴管则可以因为它需要清洗.在实验室中鉴别食盐和蔗糖时不能用品尝的方法;在家中的厨房中就可以用品尝的方法来鉴别.只要答案合理均可,这是一个开放型题目.
故答案为:
Fe(OH)3;4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe(OH)2和Fe(OH)3的混合物
方法一:(1)煮沸;(2)少量植物油;(3)防止氧气进入溶液中或防止Fe(OH)2与O2接触或其它正确方法
方法二:(1)Fe+H2SO4=FeSO4+H2↑;(3)在A处收集氢气进行验纯
H2SO4+2NaOH=Na2SO4+2H2O;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;
(4)隔绝了氧气;
(5)Fe2O3
反思与应用:(1)如果是滴瓶上的专用滴管不可以,若是另取的滴管则可以
(2)在实验室中鉴别食盐和蔗糖时不能用品尝的方法;在家中的厨房中就可以用品尝的方法来鉴别.答案合理均可
注:若有其它合理答案,均可
点评:通过回答本题知道了由于Fe(OH)2不稳定在制取它时很难,需要想法隔绝空气中的氧气,还练习了化学方程式的书写,进一步熟悉了方程式的书写步骤.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
 28、Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH-A↓+NaCl,则A沉淀是
28、Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH-A↓+NaCl,则A沉淀是