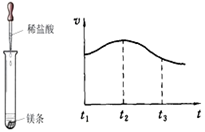
题目内容
为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作b的名称是 ;该操作中需要使用玻璃棒,其作用是 。
(3)写出步骤②所涉及的化学反应方程式: ,该反应的基本类型是 。
(4)实验步骤②中除了加入适量的稀硫酸外,还可选用适量的下列试剂 (填标号)。
a.硫酸铜溶液 b.氯化钠溶液 c.硝酸银溶液
((1)铁 铜 (2)蒸发结晶 防止局部温度过高造成液滴飞溅
(3)Mg + H2SO4 = MgSO4 + H2↑ 置换反应 (4)a
解析试题分析:(1)铁能够被磁铁吸引,因此A是铁;镁和铜的混合物中,加入适量的稀硫酸,镁和硫酸反应生成硫酸镁和氢气,铜不反应,因此过滤可以得到B,即金属铜;(2)在操作b后由溶液得到了硫酸镁晶体,所以应为蒸发结晶,蒸发时用玻璃棒搅拌,防止局部温度过高造成液滴飞溅;(3)步骤②中所发生的反应为镁和稀硫酸的反应,该反应生成了硫酸镁和氢气,据此写出该反应的化学方程式:Mg+H2SO4═MgSO4+H2↑;因为反应物是一种单质和一种化合物反应生成另一种单质和化合物的反应,属于置换反应。(4)镁的活动性比铜强,所以可以用硫酸铜来代替稀硫酸完成该实验。故选a
考点:金属的化学性质,过滤的原理、方法及其应用,常见金属的特性及其应用,书写化学方程式、文字表达式、电离方程式

小红发现,金店里有两种不同的“白金”,单价相差悬殊,小红很好奇,打算进行研究。
【查阅资料】市场上所谓的“白金”通常有两种,一种是金、镍、铜、锌的合金,称为白色金;另一种是铂金,铂是一种银白色的贵重金属,用于耐腐蚀的化学仪器及首饰等,俗称“白金”,元素符号Pt。小红结合化学课上学习的金属活动性顺序,展开了下列实验活动。
(1)鉴别两种白金,她的方法可能是________________________;
(2)探究Zn、Ni(镍)、Cu的活动性顺序。
【做出假设】对三种金属的活动性顺序提出可能的假设①Zn>Ni>Cu;②Zn>Cu>Ni你觉得还有其他的可能性吗?请把它们写出来(一种即可)
假设:③______________________…………
【查阅资料】小红同学查阅了部分含镍化合物的溶解性如下表所示,且得知镍能与酸反应。
| | OH- | NO3- | SO42- | Cl- |
| Ni2+ | 不 | 溶 | 溶 | 溶 |
【设计实验】同温下,取大小、厚度相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象。
【记录现象】请帮助小红把实验现象填写完整
| 金属 | Ni | Zn | Cu |
| 与盐酸反应的现象 | 气体产生缓慢, 金属逐渐溶解 | 气体产生迅速, 金属迅速溶解 | |
【得出结论】原假设中正确的是__________(填序号),写出镍与盐酸反应的化学方程式:___________________________。
【结论应用】①根据探究结果,请你预测镍与硫酸铜溶液____________(填“能”或“不能”)反应,理由是____________________。
②除小红的实验设计外,你能否像小红一样,设计另一组实验,也这样依次验证上述假设的正确与否,你的设计所用到的一组物质的化学式是__________(写出一组即可)。
早在春秋战国时期,我国就开始生产和使用铁器。
(1)写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式 ,盛水的铁锅与水面接触的一圈最易生锈,钢铁生锈的条件是 ,利用新技术能将不锈钢加工成柔软的金属丝,这是利用了不锈钢的 (填字母)。
| A.耐腐蚀性 | B.延展性 | C.导热性 | D.导电性 |
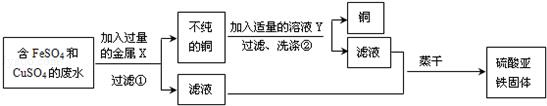
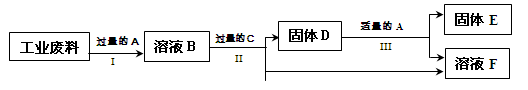
金属X是 ,写出上述实验方案中有关反应的化学方程式
① ;② 。
燃煤产生的烟气中含有二氧化硫,直接排放会污染空气,它与水反应形成酸雨污染环境,某科研小组利用海水除去二氧化硫,其工艺流程见下图:
请回答下列问题:
(1)二氧化硫中硫的化合价是 。
(2)用熟石灰中和稀硫酸的化学方程式是 。
(3)亚硫酸(H2SO3)被空气中氧气氧化为硫酸,写出反应的化学方程式 。
(4)为了研究脱硫率(脱硫率是已除去的二氧化硫的量占总二氧化硫量的百分比——与温度、烟气中SO2浓度的关系,他们进行了探究实验。实验结果如下:
| 实验序号 | 温度/℃ | 烟气中SO2浓度/10-2g·L-1 | 脱硫率/% |
| I | 23 | 2.5% | 99.5 |
| II | 23 | 3.2% | 97.1 |
| III | 40 | 2.5% | 94.3 |
(5)目前,科学家正在研究在一定条件下将乙烯(C2H4)和烟气混合除去二氧化硫,其反应的过程可分为如下三步:
第一步:O2与Cu+反应生成Cu+(O2)
第二步:Cu+(O2)与SO2反应生成Cu+(SO3)2
第三步:Cu+(SO3)2与C2H4反应生成S、CO2、H2O和Cu+。
①反应中Cu+的作用是 。
②除去二氧化硫的总反应的化学方程式是 。