题目内容
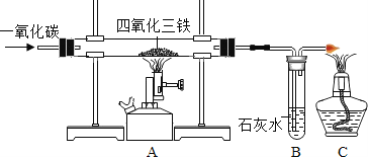
【题目】根据如图所示装置回答有关问题:
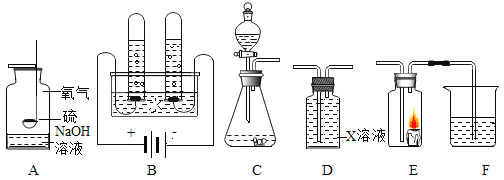
(1)A为硫在氧气燃烧的实验,氢氧化钠溶液的作用为_____。
(2)B是模拟工业制取氢氧化钠,电解一段时间后,两支试管分别收集到氯气和一种可燃性气体,溶液呈碱性,则溶液中发生的反应方程式为_____,随着实验进行,溶液的 pH将_____(填“变大”、“变小”、“不变”)。
(3)实验室用 C、D装置制干燥的氢气,X溶液应为_____。
(4)某同学连接 C、E、F进行实验。
①若实验时 E中蜡烛熄灭,F中溶液变浑浊,则C中反应的化学方程式为_____;
②若实验时 E中蜡烛燃烧更旺,F中溶液变浑浊,则F中反应的化学方程式为_____。
【答案】吸收生成的二氧化硫,防止污染环境 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 变大 浓硫酸 CaCO3+2HCl═CaCl2+H2O+CO2↑ CO2+Ca(OH)2═CaCO3↓+H2O
2NaOH+H2↑+Cl2↑ 变大 浓硫酸 CaCO3+2HCl═CaCl2+H2O+CO2↑ CO2+Ca(OH)2═CaCO3↓+H2O
【解析】
(1)氢氧化钠能与二氧化硫反应生成,可用氢氧化钠吸收二氧化硫;
(2)氢气具有可燃烧,氢氧化钠溶液溶液显碱性;
(3)浓硫酸有吸水性,可用于干燥氢气;
(4)二氧化碳不燃烧、不支持燃烧,因此E中蜡烛熄灭;二氧化碳可用澄清石灰水检验,澄清石灰水变浑浊,说明有二氧化碳生成。
(1)硫燃烧生成二氧化硫,氢氧化钠溶液能够吸收生成的二氧化硫,从而防止污染环境;故填:吸收生成的二氧化硫,防止污染环境;
(2)根据质量守恒定律,饱和氯化钠溶液电解一段时间后,两支试管分别收集到氯气和一种可燃性气体,溶液呈碱性,该气体是氢气,且生成了氢氧化钠溶液,所以反应物是氯化钠和水,生成物是氢氧化钠、氢气和氯气,反应条件是通电,反应的反应方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。碱性越强,溶液的pH越大,随着实验进行,生成氢氧化钠溶液的浓度增大,溶液的pH将变大。
2NaOH+H2↑+Cl2↑。碱性越强,溶液的pH越大,随着实验进行,生成氢氧化钠溶液的浓度增大,溶液的pH将变大。
故填:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;变大;
2NaOH+H2↑+Cl2↑;变大;
(3)浓硫酸有吸水性,可用于干燥氢气,X溶液应为浓硫酸;故填:浓硫酸;
(4)①实验时E中蜡烛熄灭,F中溶液变浑浊,则C中反应产生的气体是二氧化碳,大理石和稀盐酸反应生成氯化钙、二氧化碳和水;二氧化碳不燃烧、不支持燃烧,因此E中蜡烛熄灭,故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;
②实验时E中蜡烛燃烧更旺,说明生成的气体是氧气,F中溶液变浑浊是蜡烛燃烧生成的二氧化碳与石灰水的反应,化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O;故填:CO2+Ca(OH)2═CaCO3↓+H2O。