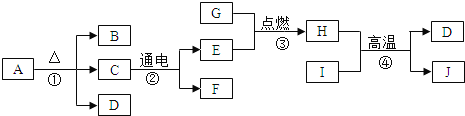
��Ŀ����
����Ŀ���±�������غ��Ȼ���ڲ�ͬ�¶�ʱ���ܽ�ȡ������������ݣ��ش����⡣
�¶�/�� | 0 | 20 | 40 | 60 | |
�ܽ��/g | ����� | 13.3 | 31.6 | 63.9 | 110 |
�Ȼ�� | 29.4 | 37.2 | 45.8 | 55.2 | |
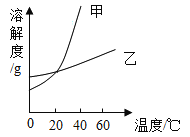
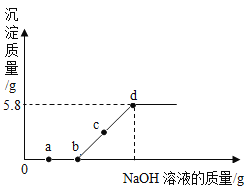
��1����ͼ�У��ɱ�ʾ___���ѧʽ�����ܽ�����ߡ�
��2��40��ʱ���������ʵı�����Һ�У���������������С����__���ѧʽ����
��3��20��ʱ������ͼ��ʾ������B����Һ���������ܼ�������Ϊ_____������������ȣ���C�е���Һ��__����������������������������Һ��
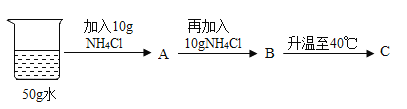
��4��60��ʱ�����������ʵı�����Һ��100g���ֱ��������10gˮ���ٻָ���60�棬ʣ����Һ���������������Һ__������>����<������=�����Ȼ����Һ��
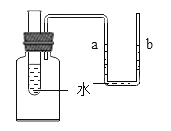
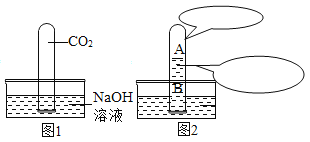
��5�������£���ʢ������صı�����Һ���Թܷ���ʢ��ˮ���ձ��У������ձ��ڵ�ˮ�м���һ����������鱗����裬�Թ��ڿ��Թ۲쵽��������____��
���𰸡�![]()
![]() 93:250 ������ < �а�ɫ��������
93:250 ������ < �а�ɫ��������
��������
��1�����Ȼ�狀�����ص��ܽ�ȿ�֪������ص��ܽ�����¶ȱ仯��������ͼ1���ܱ�ʾ![]() �ܽ�����ߵ��Ǽף�
�ܽ�����ߵ��Ǽף�
��2���ݱ�����Һ�����ʵ���������= ![]() ����֪�ܽ�ȴ�����Һ���ʵ�����������40��ʱ
����֪�ܽ�ȴ�����Һ���ʵ�����������40��ʱ![]() ���ܽ�ȱ�����ص��ܽ��С�������������ʵı�����Һ�У�
���ܽ�ȱ�����ص��ܽ��С�������������ʵı�����Һ�У�![]() ��Һ��������������С��
��Һ��������������С��
��3��20��ʱ��![]() �ܽ��Ϊ37.2g����ʱ50gˮ��������ܽ�18.6g
�ܽ��Ϊ37.2g����ʱ50gˮ��������ܽ�18.6g![]() ����B��ҺΪ20���µı���
����B��ҺΪ20���µı���![]() ��Һ��B����Һ���������ܼ�������Ϊ18.6g��50g=93:250��B��Һ������40��õ�C��Һ��40��ʱ��
��Һ��B����Һ���������ܼ�������Ϊ18.6g��50g=93:250��B��Һ������40��õ�C��Һ��40��ʱ��![]() �ܽ��Ϊ45.8g��50gˮ��������ܽ�22.9g
�ܽ��Ϊ45.8g��50gˮ��������ܽ�22.9g![]() ����C�е���Һ�Dz�������Һ��
����C�е���Һ�Dz�������Һ��
��4��60��ʱ��![]() ���ܽ��С��
���ܽ��С��![]() ���ܽ�ȣ�60��ʱ�����������ʵı�����Һ��100g���ֱ��������10gˮ���ٻָ���60�棬
���ܽ�ȣ�60��ʱ�����������ʵı�����Һ��100g���ֱ��������10gˮ���ٻָ���60�棬![]() �����ľ����٣�����ʣ����Һ�������������Һ<�Ȼ����Һ��
�����ľ����٣�����ʣ����Һ�������������Һ<�Ȼ����Һ��
��5��������ܽ�����¶Ƚ��Ͷ���С��������ܽ�ʱ���ȣ������£���ʢ������صı�����Һ���Թܷ���ʢ��ˮ���ձ��У������ձ��ڵ�ˮ�м���һ����������鱗����裬�Թ��ڿ��Թ۲쵽���������а�ɫ����������

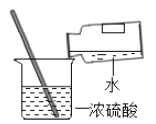
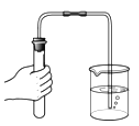
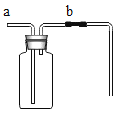
����Ŀ��ijͬѧ������ͼ����ʵ�顣
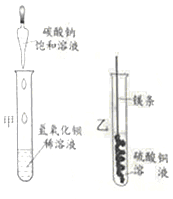
��l����ʵ���з�Ӧ�Ļ�ѧ����ʽΪ____________��
��2����ʵ��۲쵽��������___________����Һ����ɫ�����ɫ��
��3���Ѽס��ҷ�Ӧ�����Һ����ͬһ�ջ��������а�ɫ�������ɡ���������ɫ�����ijɷֽ���̽����
���������ϡ����ᱵ�������ᡣ
��������롿 ��ɫ����Ϊ����._______����.Mg(OH)2��BaSO4������Mg(OH)2��MgCO3.
��ʵ�鷽����
ʵ����� | ʵ����������� |
���ˡ�ϴ�Ӱ�ɫ�������ã����ɫ�����м������������� | ��������ȫ���ܽ⣬�����������������������仯ѧ��Ӧ����ʽΪ____________�� ����______������������������������� ����������ȫ�ܽ⣬________�������������� |
����չ��˼������������������������˽����ԭ��������ʵ��ʱ___________��������ɫ�����ijɷֲ����ܳ��ֵ������Mg(OH)2��MgCO3��BaSO4��ԭ����__________________��