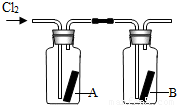
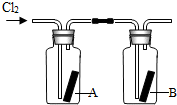
题目内容
1774年,瑞典化学家舍勒用二氧化锰和浓盐酸反应制得氯气,从而发现了氯元素,此反应为MnO2+4HCl MnCl2+2H2O+Cl2↑,通常状况下,氯气呈黄绿色,有刺激性气味,有毒.结合所给装置回答下列问题:
MnCl2+2H2O+Cl2↑,通常状况下,氯气呈黄绿色,有刺激性气味,有毒.结合所给装置回答下列问题:
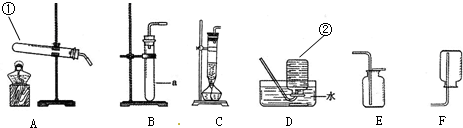
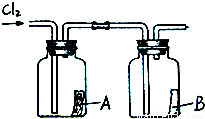
(1)写出标号仪器的名称:①______;②______.
(2)实验室制取氯气的发生装置是______.
(3)收集氯气只能用E装置,说明氯气密度______空气(填“大于”或“小于”);且______溶于水(填“能”或“不能”).
解:(1)根据常用仪器可知标号仪器分别是试管、集气瓶;
故答案为:试管;集气瓶;
(2)结合题目所给信息,MnO2+4HCl MnCl2+2H2O+Cl2↑,由此可知制取氯气是由固体和液体反应,且需加热,故选C发生装置;
MnCl2+2H2O+Cl2↑,由此可知制取氯气是由固体和液体反应,且需加热,故选C发生装置;
故答案为:C;
(3)用向上排空气法收集的气体,说明其密度比空气大,且不与空气中气体发生反应;不能用排水法收集的气体说明气体能溶于水,或与水发生化学反应;
故答案为:大于;能.
分析:(1)根据常用仪器回答;
(2)结合题目所给信息,根据反应物的状态和反应条件选择发生装置;
(3)用向上排空气法收集的气体,说明其密度比空气大,且不与空气中气体发生反应;不能用排水法收集的气体说明气体能溶于水,或与水发生化学反应.
点评:能熟练掌握装置的选取方法并会灵活应用是解答此题的关键,较好的考查了学生分析信息、应用知识解决问题的能力.
故答案为:试管;集气瓶;
(2)结合题目所给信息,MnO2+4HCl
 MnCl2+2H2O+Cl2↑,由此可知制取氯气是由固体和液体反应,且需加热,故选C发生装置;
MnCl2+2H2O+Cl2↑,由此可知制取氯气是由固体和液体反应,且需加热,故选C发生装置;故答案为:C;
(3)用向上排空气法收集的气体,说明其密度比空气大,且不与空气中气体发生反应;不能用排水法收集的气体说明气体能溶于水,或与水发生化学反应;
故答案为:大于;能.
分析:(1)根据常用仪器回答;
(2)结合题目所给信息,根据反应物的状态和反应条件选择发生装置;
(3)用向上排空气法收集的气体,说明其密度比空气大,且不与空气中气体发生反应;不能用排水法收集的气体说明气体能溶于水,或与水发生化学反应.
点评:能熟练掌握装置的选取方法并会灵活应用是解答此题的关键,较好的考查了学生分析信息、应用知识解决问题的能力.

练习册系列答案
相关题目
 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).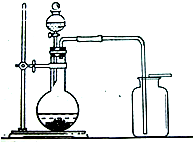 1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味.1810年,英国化学家戴维确定这种气体为氯气(Cl2).氯气有剧毒,密度比空气大,约为空气密度的2.5倍,能溶于水,氯气的化学性质活泼,能与水、金属、碱等发生化学反应,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠(NaClO).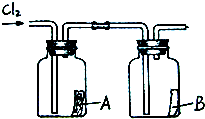
 2H2O+_______+Cl2↑.
2H2O+_______+Cl2↑.

 2H2O+______+Cl2↑.
2H2O+______+Cl2↑.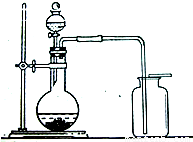
 2H2O+______+Cl2↑.
2H2O+______+Cl2↑.