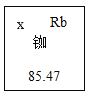
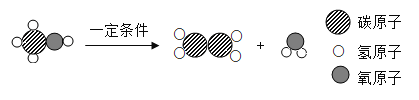题目内容
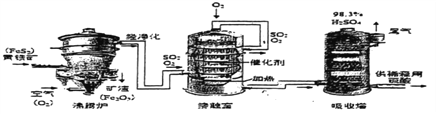
【题目】工业制取硝酸的流程如下:
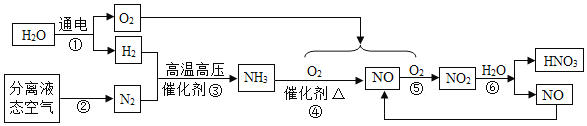
(1)步骤④的化学方程式为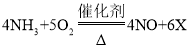 ,X的化学式为________________。
,X的化学式为________________。
(2)氢气作为最理想的燃料,它的优点有________________(写一条即可)
(3)该流程中循环使用的物质是__________________(填一种)。
【答案】H2O 燃烧产物是水,没有任何污染(合理均可) NO
【解析】
(1)由质量守恒定律可知,反应前后原子数目不变,反应前有4个氮原子,12个氢原子和10个氧原子,反应后目前有4个氮原子,4个氧原子,所以还应有12个氢原子和6个氧原子,X的系数为6,剩余的原子数中提出公因数6后,剩余2个氢原子和1个氧原子,正好组成1个水分子,即化学式为H2O,所以X为H2O;
(2)氢气与氧气燃烧后,产物只有水,不产生温室气体,也不产生硫化物等污染环境,所以其优点为燃烧后产物是水,没有任何污染;
(3)在经过⑥反应后生成了NO,NO重新进入⑤中反应,制得NO2再进行⑥的反应,所以NO实现循环使用。

【题目】某化学课外活动小组在实验室配制石灰水,并完成石灰水与稀盐酸的反应。
(1)小明同学将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有未溶解的固体,于是他认为熟石灰样品已经变质,你认为熟石灰变质的可能原因是(用化学方程式表示)___________。小莉同学不同意他的判断,你认为小莉的理由是___________。小莉同学把烧杯中的物质过滤,取滤液少许于试管中滴加酚酞试液,酚酞变红。
(2)该小组同学使用配制好的氢氧化钙溶液和稀盐酸做中和反应实验,向烧杯中的氢氧化钙溶液加入一定量稀盐酸后,发现忘记滴加指示剂了,因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式:______________。
Ⅱ、探究烧杯内溶液中溶质的成分。
(提出问题)该烧杯内溶液中的溶质是什么?
(猜想)甲、乙、丙三位同学分别作出了猜想,请你补充丁同学的猜想。
甲:可能是![]() 和
和![]() ;
;
乙:可能是![]() 和
和![]() ;
;
丙:可能是![]() 、
、![]() 和
和![]() ;
;
丁:可能__________(填物质的化学式)。
(查阅资料)氯化钙溶液呈中性。
(进行实验)
实验步骤 | 实验操作 | 实验现象 | 实验结论 |
实验1 | 取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡 | ____________ | 同学甲猜想不正确 |
实验2 | 另取少量烧杯内溶液于试管中,逐滴加入碳酸钠溶液至过量 | 先有气体产生,后产生沉淀 | 同学__________猜想正确 |
(反思与拓展)
A你认为四位同学的猜想中不需做实验就可以否定的是________。
B根据所学化学知识,若验证停止滴加盐酸后的烧杯内溶液的溶质含有![]() ,除以上方案外,下列物质中的_________单独使用也能完成该实验(填序号,可多选)。
,除以上方案外,下列物质中的_________单独使用也能完成该实验(填序号,可多选)。
a pH试纸铜 b铜 c硝酸银 d氧化铁
C烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是(写一条)。_____________。