题目内容
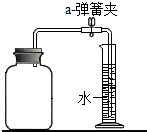
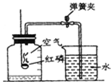
为测定空气中氧气的含量,小华同学打算设计如下方案:选实际容积为40毫升的试管做反应容器.将过量白磷放入试管中,用橡皮塞塞紧试管口,通过导管与实际容积为60毫升,且润滑性很好的针筒注射剂组成如图. 假设此实验能按小华的设想正常进行且白磷和导管内空气所占体积忽略不计,请回答下列问题:①实验钱前,打开弹簧夹,将注射剂的活塞前远沿从20毫升推至15毫升刻度处,然后松手,若活塞仍能返回至20毫升刻度处,则说明
②若现夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后,再松开弹簧夹,可观察到注射器活塞停留在 ml处
③若不使用弹簧夹,用酒精灯加热白磷,充分反应后,试管冷却,可观察到注射器活塞停留在 ml处
④若按小华的设想进行实验,实际遇到诸多问题而发生危险,造成实验失败.如 .

【答案】分析:本题是测定空气中氧气的含量,我们常用燃烧红磷或白磷的方法,因为磷燃烧生成白色固体五氧化二磷,几乎不占空间,使得内外产生气压差,从而得到正确的结论.因此在选择可燃物时,必须考虑到:燃烧的条件;生成物的状态;不与空气中其他物质发生反应.保证本实验成功的关键是:①装置气密性好;②白磷要足量;③要冷却至室温再读数.如图所示,试管和注射器内空气的总体积为60毫升,可以根据氧气约占空气体积的五分之一,来推算活塞的位置.
解答:解:①打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明该装置不漏气;
②由于白磷燃烧消耗了容积为40mL的试管内空气的 ,也就是8mL(即400mL×的
,也就是8mL(即400mL×的 );所以活塞所处的刻度值为20mL-8mL=12mL;
);所以活塞所处的刻度值为20mL-8mL=12mL;
③试管和注射器内空气的总体积为60毫升,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却,活塞向左移动12毫升,因此活塞固定在20mL-12mL=8mL处;
④造成该实验失败的原因较多,例如:装置漏气,白磷不足等.
故答为:①装置不漏气;②12;③8;④装置漏气,白磷不足等.
点评:本题主要考查用白磷测定空气组成的实验原理、操作、现象、结论和注意事项,难度稍大.注意尤其是注射器类似的本身内部有气体的可能的干扰就是要强调对题意的准确把握.
解答:解:①打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明该装置不漏气;
②由于白磷燃烧消耗了容积为40mL的试管内空气的
 ,也就是8mL(即400mL×的
,也就是8mL(即400mL×的 );所以活塞所处的刻度值为20mL-8mL=12mL;
);所以活塞所处的刻度值为20mL-8mL=12mL;③试管和注射器内空气的总体积为60毫升,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却,活塞向左移动12毫升,因此活塞固定在20mL-12mL=8mL处;
④造成该实验失败的原因较多,例如:装置漏气,白磷不足等.
故答为:①装置不漏气;②12;③8;④装置漏气,白磷不足等.
点评:本题主要考查用白磷测定空气组成的实验原理、操作、现象、结论和注意事项,难度稍大.注意尤其是注射器类似的本身内部有气体的可能的干扰就是要强调对题意的准确把握.

练习册系列答案
相关题目
 请回答下列问题:
请回答下列问题:
 甲同学对寒痛乐熨剂(简称“寒痛乐”)的发热原理产生了浓厚兴趣,于是带了几包寒痛乐,来到实验室对其进行研究.
甲同学对寒痛乐熨剂(简称“寒痛乐”)的发热原理产生了浓厚兴趣,于是带了几包寒痛乐,来到实验室对其进行研究.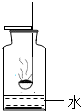 用一条形磁铁与烧杯中的黑色粉末充分接触,取适量吸附在磁铁上的黑色粉末放于燃烧匙中,在酒精灯上点燃后伸入盛有氧气的集气瓶中,观察
用一条形磁铁与烧杯中的黑色粉末充分接触,取适量吸附在磁铁上的黑色粉末放于燃烧匙中,在酒精灯上点燃后伸入盛有氧气的集气瓶中,观察