题目内容
实验室欲配制50g5%的NaCl溶液,常按下列实验步骤进行:
(1)计算:需要NaCl质量为 g,水的体积约 mL.
(2)称量:托盘天平只能准确称量到 g.检查时,若发现指针偏右,应将平衡螺母向左调节至平衡.称量时若把砝码放在左盘(1g以下用游码),则称得NaCl的质量为 g.若量取水的操作正确,所配溶液中溶质的质量分数实际为 .要把该溶液变成5%的溶液.需再加NaCl g.
(3)溶解:应选择的量筒规格是 (填“50mL”或“100mL”),量取时,若仰视刻度线,则量筒的读数偏 ,实际水体积偏 ,所配制溶液中溶质的质量分数偏 .
(1)计算:需要NaCl质量为
(2)称量:托盘天平只能准确称量到
(3)溶解:应选择的量筒规格是
分析:(1)溶质的质量=溶液的质量×溶质的质量分数,溶剂的质量=溶液的质量-溶质的质量,并据m=ρv分析解答;
(2)托盘天平能准确到0.1g,物码倒置时称量物的质量=砝码的质量-游码的质量;并据溶质的质量分数=
×100%计算解答;
(3)量筒选取与所量液体体积相近,仰视刻度,读数偏小,实际量取的水偏大,则溶质的质量分数偏小.
(2)托盘天平能准确到0.1g,物码倒置时称量物的质量=砝码的质量-游码的质量;并据溶质的质量分数=
| 溶质的质量 |
| 溶液的质量 |
(3)量筒选取与所量液体体积相近,仰视刻度,读数偏小,实际量取的水偏大,则溶质的质量分数偏小.
解答:解:(1)计算:需要NaCl质量为 50g×5%=2.5g,需要水的质量是50g-2.5g=47.5g,即水的体积约47.5mL;
(2)称量:托盘天平只能准确称量到0.1g.检查时,若发现指针偏右,应将平衡螺母向左调节至平衡.称量时若把砝码放在左盘(1g以下用游码),则称得NaCl的质量为2g-0.5g=1.5g.若量取水的操作正确,所配溶液中溶质的质量分数实际为
×100%≈3.06.要把该溶液变成5%的溶液.需再加NaCl的质量是:2.5g-1.5g=1g;
(3)溶解:水的体积约47.5mL,所以应选择的量筒规格是 50mL,量取时,若仰视刻度线,则量筒的读数偏小,实际水体积偏大,所配制溶液中溶质的质量分数偏小;
故答案为:(1)2.5;47.5;(2)0.1;1.5;3.06%;1;(3)50;小;大;小.
(2)称量:托盘天平只能准确称量到0.1g.检查时,若发现指针偏右,应将平衡螺母向左调节至平衡.称量时若把砝码放在左盘(1g以下用游码),则称得NaCl的质量为2g-0.5g=1.5g.若量取水的操作正确,所配溶液中溶质的质量分数实际为
| 1.5g |
| 47.5g+1.5g |
(3)溶解:水的体积约47.5mL,所以应选择的量筒规格是 50mL,量取时,若仰视刻度线,则量筒的读数偏小,实际水体积偏大,所配制溶液中溶质的质量分数偏小;
故答案为:(1)2.5;47.5;(2)0.1;1.5;3.06%;1;(3)50;小;大;小.
点评:本题主要考查了溶质的质量分数计算、天平的使用、量筒的误差分析等知识,掌握相关知识才能正确解答.

练习册系列答案
相关题目
 实验室欲配制50g5%的NaCl溶液,试回答下列问题.
实验室欲配制50g5%的NaCl溶液,试回答下列问题.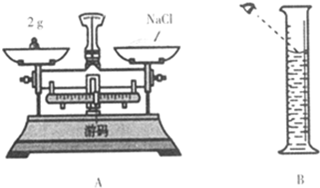 实验室欲配制50g5%的NaCl溶液,试回答下列问题.
实验室欲配制50g5%的NaCl溶液,试回答下列问题.