题目内容
阳光牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水.使用一段时间后,其中的Fe粉会转变成Fe2O3而变质.某化学兴趣小组欲探究使用过的阳光牌“脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程.[收集资料](1)Fe(OH)2在空气中可氧化成Fe(OH)3;
(2)难溶性碱受热不稳定,可生成相应的金属氧化物.
[实验探究]
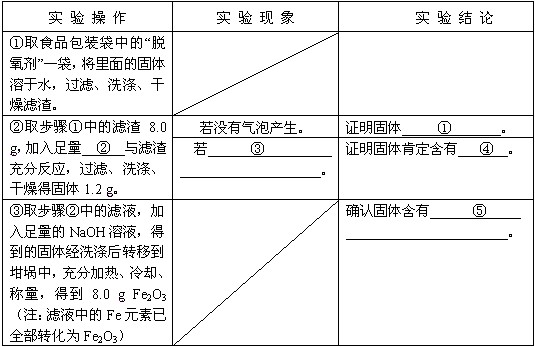
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| ①取食品包装袋中的“脱氧剂”一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣. | 无 | 无 |
| ②取步骤①中的滤渣8.0 g,加入足量②______与滤渣充分反应,过滤、洗涤、干燥得固体1.2 g. | 若没有气泡产生. | 证明固体①______. |
| 若③______. | 证明固体肯定含有④______. | |
| ③取步骤②中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0 g Fe2O3(注:滤液中的Fe元素已全部转化为Fe2O3) | 无 | 确认固体含有⑤______. |
【答案】分析:先用水除去脱氧剂中的NaCl、水,滤渣为Fe粉、活性炭及Fe2O3,加入盐酸将铁和氧化铁转化为铁盐和亚铁盐.然后再加氢氧化钠转化为氢氧化铁,氢氧化铁加热转化为氧化铁,从而得出脱氧剂的变质程度.
解答:解:铁与盐酸反应生成氢气,所以若没气泡冒出,说明不含铁.固体部分溶解证明含有碳.再加氢氧化钠将铁盐和亚铁盐转化为氢氧化铁和氢氧化亚铁,氢氧化亚铁在空气中转化为氢氧化铁,加热氢氧化铁转化为氧化铁.然后再计算脱氧剂的变质程度.
故答案为:①不含Fe;②H2SO4或HCl;③固体部分溶解;
④C;⑤Fe和Fe2O3的混合物
⑥混合物中Fe和Fe2O3的质量为:8.0g-1.2g=6.8g
由6.8gFe和Fe2O3的混合物完全转化为氧化铁时所需的氧元素的质量为8.0g-6.8g=1.2g
故变质后氧化铁的质量为:1.2g÷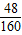 ×100%=4g
×100%=4g
剩余铁的质量为6.8g-4g=2.8g
脱氧剂的变质程度为:
 ×100%=50%.
×100%=50%.
点评:在计算脱氧剂的变质程度时,一定要明确变质程度为已变质的Fe粉占变质前Fe粉的质量分数.
解答:解:铁与盐酸反应生成氢气,所以若没气泡冒出,说明不含铁.固体部分溶解证明含有碳.再加氢氧化钠将铁盐和亚铁盐转化为氢氧化铁和氢氧化亚铁,氢氧化亚铁在空气中转化为氢氧化铁,加热氢氧化铁转化为氧化铁.然后再计算脱氧剂的变质程度.
故答案为:①不含Fe;②H2SO4或HCl;③固体部分溶解;
④C;⑤Fe和Fe2O3的混合物
⑥混合物中Fe和Fe2O3的质量为:8.0g-1.2g=6.8g
由6.8gFe和Fe2O3的混合物完全转化为氧化铁时所需的氧元素的质量为8.0g-6.8g=1.2g
故变质后氧化铁的质量为:1.2g÷
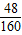 ×100%=4g
×100%=4g剩余铁的质量为6.8g-4g=2.8g
脱氧剂的变质程度为:
 ×100%=50%.
×100%=50%.点评:在计算脱氧剂的变质程度时,一定要明确变质程度为已变质的Fe粉占变质前Fe粉的质量分数.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
阳光牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水.使用一段时间后,其中的Fe粉会转变成Fe2O3而变质.某化学兴趣小组欲探究使用过的阳光牌“脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程.
[收集资料](1)Fe(OH)2在空气中可氧化成Fe(OH)3;
(2)难溶性碱受热不稳定,可生成相应的金属氧化物.
[实验探究]
[数据处理]请计算:该“脱氧剂”的变质程度 (⑥).
[收集资料](1)Fe(OH)2在空气中可氧化成Fe(OH)3;
(2)难溶性碱受热不稳定,可生成相应的金属氧化物.
[实验探究]
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| ①取食品包装袋中的“脱氧剂”一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣. | 无 | 无 |
| ②取步骤①中的滤渣8.0 g,加入足量② |
若没有气泡产生. | 证明固体① |
| 若③ |
证明固体肯定含有④ | |
| ③取步骤②中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0 g Fe2O3(注:滤液中的Fe元素已全部转化为Fe2O3) | 无 | 确认固体含有⑤ |
阳光牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水.使用一段时间后,其中的Fe粉会转变成Fe2O3而变质.某化学兴趣小组欲探究使用过的阳光牌“脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程.
[收集资料](1)Fe(OH)2在空气中可氧化成Fe(OH)3;
(2)难溶性碱受热不稳定,可生成相应的金属氧化物.
[实验探究]
[数据处理]请计算:该“脱氧剂”的变质程度 (⑥).
[收集资料](1)Fe(OH)2在空气中可氧化成Fe(OH)3;
(2)难溶性碱受热不稳定,可生成相应的金属氧化物.
[实验探究]
| 实 验 操 作 | 实 验 现 象 | 实 验 结 论 |
| ①取食品包装袋中的“脱氧剂”一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣. | 无 | 无 |
| ②取步骤①中的滤渣8.0 g,加入足量②______与滤渣充分反应,过滤、洗涤、干燥得固体1.2 g. | 若没有气泡产生. | 证明固体①______. |
| 若③______. | 证明固体肯定含有④______. | |
| ③取步骤②中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0 g Fe2O3(注:滤液中的Fe元素已全部转化为Fe2O3) | 无 | 确认固体含有⑤______. |