题目内容
(4分)在完成实验“二氧化碳的制取”后,废液桶中倾倒了含有较多盐酸的混合溶液。为避免酸液污染环境,化学兴趣小组做了如下实验:取废液60g,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH与加入的碳酸钠溶液的质量关系如下图所示:(不考虑CO2溶于水对溶液酸碱性的影响)
【小题1】通过上图可知,当碳酸钠溶液质量加到 g时,废液中的盐酸恰好处理完。
【小题2】计算废液中氯化钙的质量分数。
【小题1】50g;
【小题2】9.25%解析:
【小题1】当溶液pH值刚好为7时,说明废液中的盐酸恰好处理完,通过上图可知所加碳酸钠溶液质为50g
【小题2】通过图像来看,中间pH不变的过程,就是碳酸钠和氯化钙反应的过程,故参加反应的碳酸钠的溶液量为75-50=25g,据此就可以求出氯化钙
解: 设溶液中含氯化钙的质量为x
Na2CO3 + CaCl2 CaCO3 ↓ + 2NaCl
106 111
21.2%×25g x
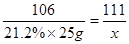
x = 5.55g …………………………………… 2分
C% =
 ×100% =9.25% ……………………………………1分
×100% =9.25% ……………………………………1分 
练习册系列答案
相关题目
 (2012?丰台区一模)在完成实验“二氧化碳的制取”后,废液桶中倾倒了含有较多盐酸的混合溶液.为避免酸液污染环境,化学兴趣小组做了如下实验:取废液60g,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如右图所示:(不考虑CO2溶于水对溶液酸碱性的影响)
(2012?丰台区一模)在完成实验“二氧化碳的制取”后,废液桶中倾倒了含有较多盐酸的混合溶液.为避免酸液污染环境,化学兴趣小组做了如下实验:取废液60g,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如右图所示:(不考虑CO2溶于水对溶液酸碱性的影响)

 (2)计算废液中氯化钙的质量分数。
(2)计算废液中氯化钙的质量分数。