题目内容
【题目】对下列实验中出现的异常现象,分析合理的是(______)
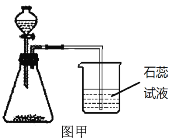
A、制取CO2时,始终收集不到气体——收集CO2的集气瓶没盖严
B、测量空气中氧气含量时,测量值小于1/5——伸入白磷的速度过慢
C、过滤时发现过滤速度很慢——滤纸没有紧贴烧杯内壁
D、向澄清石灰水中通新制取出的CO2,沉淀消失——____________________________(化学方程式)
【答案】C CaCO3+H2O+CO2=Ca(HCO3)2
【解析】
A.制取二氧化碳时,始终收集不到气体,可能是由于装置漏气所引起;而收集时集气瓶没盖严并不影响气体的收集.故错误;
B.测量空气中氧气含量时,测量值大于![]() ,可能是伸入白磷的速度过慢,造成装置内的空气受热膨胀逸出造成的,而小于
,可能是伸入白磷的速度过慢,造成装置内的空气受热膨胀逸出造成的,而小于![]() ,则可能是磷的量不足、装置漏气等原因造成的,故错误;
,则可能是磷的量不足、装置漏气等原因造成的,故错误;
C.过滤时若滤纸没有紧贴烧杯内壁,则造成过滤速度太慢,故正确;
D.二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,继续通入二氧化碳,则碳酸钙与水、二氧化碳反应生成了可溶性的碳酸氢钙,所以沉淀消失.
故答案为:C;CaCO3+H2O+CO2=Ca(HCO3)2.

【题目】气在生产、生活中有广泛用途,研究其制取、性质和用途十分重要.
(1)工业上用氮气和氢气在高温高压和催化剂存在时合成氨;实验室用氯化铵和熟石灰在加热条件下制取氨气,同时生成氯化钙和水.请分别写出有关反应的化学方程式___________.实验室制取氨气的发生装置与制取哪种气体的相似,请写出实验室制取该气体的化学方程式:__________
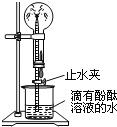
(2)如图是氨气性质的趣味实验:圆底烧瓶中充满氨气,当挤压胶头滴管并打开止水夹时,烧杯中的水迅速进入烧瓶,形成美丽的“喷泉”,进入烧瓶的水变成红色.由该实验可得出哪些结论___________
(3)氨气常作制冷剂及化肥,同时,它还可作清洁能源.已知表信息:
性质 | 颜色、气味 | 沸点(℃) | 25℃水中溶解度(g/L-1) |
NH3 | 无色、刺激性 | -33 | 456 |
H2 | 无色、无味 | -253 | 0.0015 |
一定条件下氨气在纯氧中完全燃烧生成水和氮气,写出该反应的化学方程式______________________.
液氨有望和液氢一样成为新一代绿色能源.与H2相比,用NH3作燃料的优点之一是便于储存和运输;优点之二是泄漏时易发现且便于处理.请对氨气的优点加以解释说明_________________