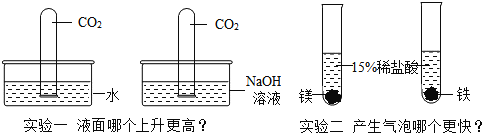
题目内容
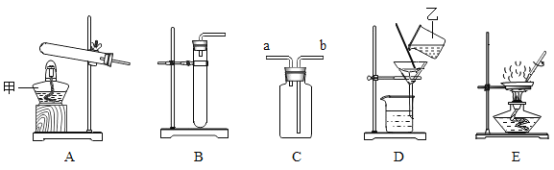
【题目】下图是配制50g质量分数为5% 的氯化钠溶液的操作过程示意图,试回答:
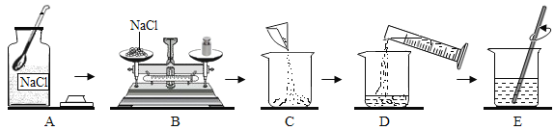
(1)放好砝码和游码后向托盘上加氯化钠时,若指针偏向分度盘的左边,应进行的操作是_________。
(2)D操作应选用__________mL的量筒(从10mL、50mL、100mL中选择);量水时,量筒必须平放,视线要跟量筒凹液面的__________处保持水平。
(3)E操作中玻璃棒的作用是__________________。
(4)如果配制过程中出现以下情况可能造成对所配溶液的溶质质量分数的误差(填“偏高”、“偏低”、“无影响”):
①量取水时俯视读数_____________________________________;
②配制完后将溶液转移至试剂瓶时洒出了一些_________________。
【答案】减少适量药品至天平平衡 50 最低 搅拌加速氯化钠溶解 偏高 无影响
【解析】
(1)放好砝码和游码后向托盘上加氯化钠时,若指针偏向分度盘的左边,说明药品质量大于砝码质量,应减少药品,直至天平平衡;
(2)配制50g质量分数为5% 的氯化钠溶液,溶质质量=溶液质量×溶质的质量分数,需氯化钠的质量=50g×5%=2.5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-2.5g=47.5g(合47.5mL),应用规格为50mL的量筒量取水的体积;量水时,量筒必须平放,视线要跟量筒凹液面的最低处保持水平;
(3)E操作是溶解操作,玻璃棒的作用是搅拌,加快溶解速率;
(4)①量取水时俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大;
②配制完后将溶液转移至试剂瓶时洒出了一些,溶液具有均一性,溶质质量分数不变。

【题目】将乙醇和氧气置于密闭容器中引燃,测得反应前后各物质的质量如表:
物质(纯净物) | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
下列说法正确的是( )
A.反应后X的质量为1.4g
B.X中一定含有碳元素和氢元素
C.X中一定含有碳元素和氧元素
D.X中两种元素的质量比为1:1