题目内容
实验室用16g高锰酸钾放在试管中加热,反应一段时间后称得试管剩余物质14.4克.
(1)求生成氧气多少克?
(2)求参加反应的高锰酸钾的质量?
解:(1)因该反应中只有氧气是气体,质量守恒定律可知,
氧气的质量为16g-14.4g=1.6g,
答:生成氧气1.6g;
(2)设参加反应的高锰酸钾的质量为x,
则2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 32
x 1.6g
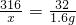 ,
,
解得x=15.8g,
答:参加反应的高锰酸钾的质量为15.8g.
分析:(1)根据质量守恒定律可知,反应前后固体的质量差即为氧气的质量;
(2)将氧气的质量代入高锰酸钾分解的化学反应方程式来计算参加反应的高锰酸钾的质量.
点评:本题考查学生利用化学反应方程式的计算,利用质量守恒定律来计算氧气的质量是解答本题的关键.
氧气的质量为16g-14.4g=1.6g,
答:生成氧气1.6g;
(2)设参加反应的高锰酸钾的质量为x,
则2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑316 32
x 1.6g
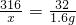 ,
,解得x=15.8g,
答:参加反应的高锰酸钾的质量为15.8g.
分析:(1)根据质量守恒定律可知,反应前后固体的质量差即为氧气的质量;
(2)将氧气的质量代入高锰酸钾分解的化学反应方程式来计算参加反应的高锰酸钾的质量.
点评:本题考查学生利用化学反应方程式的计算,利用质量守恒定律来计算氧气的质量是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目