题目内容
据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜.
(1)请完成该反应的化学方程式:2Cu+2H2SO4+O2 2CuSO4+
2CuSO4+
(2)某同学想利用此反应,将80g含铜80%的废料转化为10%的硫酸铜溶液,计算需要加入10%的稀硫酸和水的质量(假设杂质不参加反应,也不溶于水).
| (1)依据反应前后原子的种类和数目不变将方程式补充完整; (2)依据废料中铜的质量结合方程式计算参加反应的硫酸溶质的质量,生成的硫酸铜的质量、水的质量,并据溶质的质量分数解答. | |
| 解答: | 解:(1)由质量守恒定律反应前后原子的种类和数目不变进行分析,反应前铜原子的数目是2个,氢原子的数目是4个,氧原子的数目是10个,硫原子的数目是2个,反应后铜原子的个数是2个,硫原子的个数是2个,氧原子的个数是8个,故确定生成物除硫酸铜外,另一种为水,应填2H2O; (2)设生成硫酸铜的质量为x,生成水的质量为y,参加反应的硫酸的质量为z 2Cu+2H2SO4 +O2 128 196 320 36 80g×80% z x y
稀硫酸溶液的质量= 硫酸铜溶液的质量= 则加入水的质量=1600g﹣﹣160g﹣18g﹣980g×90%=540g 答:需要加入10%的稀硫酸和水的质量分别为980g、540g. 故答案为:(1)2H2O; (2)需要加入10%的稀硫酸和水的质量分别为980g、540g. |

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 =
= z=98g
z=98g =
=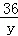 y=18g
y=18g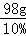 =980g
=980g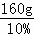 =1600g
=1600g