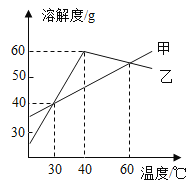
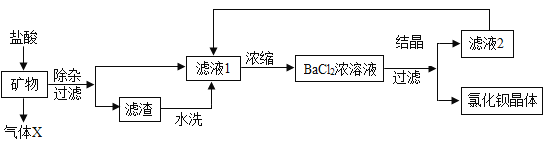
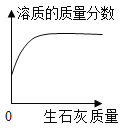
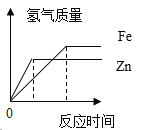
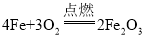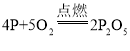��Ŀ����
����Ŀ��ij��ѧ��ȤС���ͬѧ�����ⶨijпͭ�Ͻ���п����������������������ʵ�飮ȡ�úϽ�16.00g������ͼ 14 ʢ��ϡ�������ƿ�У�������Ӧ��Zn+H2SO4=ZnSO4+H2�������ʵ���ȡƽ��ֵ�������������
��Ӧǰ | ��ַ�Ӧ��װ�ü���Ӧʣ���������� | |
װ�ú�������ϡ�������� | пͭ�Ͻ����� | |
342.10g | 16.00g | 357.70g |

�������Ǹ�������տ����е�ˮ���������㣺
��1�����������غ㶨�������ɵ���������Ϊ���� g��
��2���úϽ���п������������
���𰸡���1��0.4����2��81.25%
��������
��1����Ӧǰ�뷴Ӧ��װ�ü��ٵ�������������������������������=342.10g+16.00g��357.70g=0.4g�����0.4��
��2���ڽ����˳���У�п������֮ǰ��ͭ������֮��п�������ᷴӦ����������ͭ���������ᷴӦ����������
��úϽ���п������Ϊx��

![]()
��ã�x=13g
�úϽ���п����������=![]()
�𣺸úϽ���п����������Ϊ81.25%��

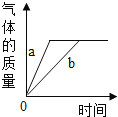
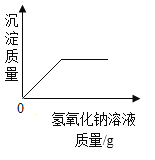
����Ŀ��ʵ��������ͼװ����ȡ������ռ�������ȷ���ǣ�������
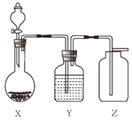
A | B | C | D | |
X | ����������Һ�� �������� | п���� ϡ���� | ����ʯ�� ϡ���� | ������� �������� |
Y | Ũ���� | Ũ���� | �������� | Ũ���� |
Z | O2 | H2 | CO2 | O2 |
A.AB.BC.CD.D
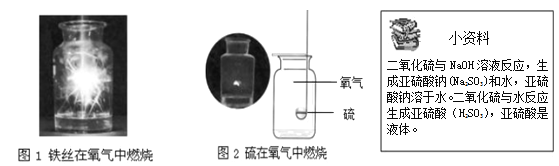
����Ŀ�����б�������ȷ���ǣ� ��
ѡ�� | ��Ӧ�P��Ӧ���� | ��Ӧ��ѧ����ʽ | ʵ������ |
A | ��˿��������ȼ�� |
| ����ȼ�գ��������䣬���ɺ�ɫ���� |
B | ���ڿ�����ȼ�� |
| �����������̣��ų��������� |
C | ��CO2ͨ�뵽������ɫʯ����Һ��ˮ�� |
| ��ɫʯ����Һ��Ϊ��ɫ |
D | ����ĥ����ͭ˿������������Һ�� |
| ͭ˿���渲��һ������ɫ���ʣ���Һ����ɫ��Ϊ��ɫ |
A.AB.BC.CD.D