题目内容
【题目】某化学兴趣小组的同学进行粗盐提纯的实验,请你帮助他们完成有关问题。(已知粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质)
实验一:去除粗盐中的泥沙
1称取粗盐样品10.0g,用30mL蒸馏水充分溶解
2过滤去除泥沙得溶液I
以上两步操作中都用到玻璃棒,试写出其中一个玻璃棒的作用:______________。
实验二:去除可溶性杂质
溶液I按如下图流程进行处理:
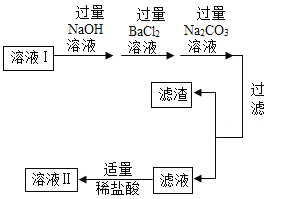
(1)加人“过量BaCl2溶液时”,发生反应的化学方程式是_____________;加入过量碳酸钠溶液除了能除去粗盐中的氯化钙外,还有一个作用是_______________。
(2)过滤后,所得的滤液中的溶质有____________(用化学式表示)。请设计实验证明滤液中含有NaOH(简要写出实验步骤和现象)___________。
(3)判断“稀盐酸适量”的方法是____________。
(4)实验后,将溶液Ⅱ注入蒸发皿中蒸发结晶,观察到____________,停止加热,利用余热蒸干。装置完全冷却后,得到干燥的产品9.4g。小组同学计算得出该粗盐样品中氯化钠的质量分数是94%。实验结果与反思:实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是__________。
【答案】搅拌或引流 Na2SO4+BaCl2=BaSO4↓+2NaCl 除去过量的氯化钡 NaOH和Na2CO3 取少量溶液于试管中,加入足量氯化钙溶液,静置后滴加酚酞试液;实验现象:先产生白色沉淀,后溶液变红色;实验结论:滤液中含有氢氧化钠 滴加稀盐酸至刚好没有气泡冒出时,说明稀盐酸刚好适量 有较多固体析出时 整个实验过程中有氯化钠生成
【解析】
实验一;
(1)步骤1是溶解,玻璃棒的作用是搅拌,加速溶解;步骤2是过滤,玻璃棒的作用是引流。
实验二:
(1)过量的氯化钡与原溶液中的硫酸钠反应生成硫酸钡沉淀和氯化钠,反应的方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl。加入过量碳酸钠溶液除了能除去粗盐中的氯化钙外,还有一个作用是除去过量的氯化钡。
(2)加入过量的氢氧化钠除去了氯化镁,加入了过滤的氯化钡除去了硫酸钠,加入过量的碳酸钠除去了氯化钙和过量的氯化钡,故过滤后滤液中的溶质有过量的氢氧化钠和过量的碳酸钠。证明过滤所得滤液中含有NaOH的实验方案是取少量溶液于试管中,加入足量氯化钙溶液,静置后滴加酚酞试液;实验现象:先产生白色沉淀,后溶液变红色;实验结论:滤液中含有氢氧化钠。
(3)滤液是氢氧化钠和碳酸钠的混合溶液,加入稀盐酸后,稀盐酸先与氢氧化钠反应,后与碳酸钠反应,当滴加稀盐酸至刚好没有气泡冒出时,说明稀盐酸刚好适量。
(4)氯化钠蒸发结晶时,当观察到有较多固体析出时,停止加热,利用余热将固体烘干。整个实验过程中有氯化钠生成,故原混合物中氯化钠的质量分数一定小于94%。

【题目】根据下图所示实验分析得出的结论中,不正确的是( )
|
|
|
|
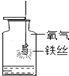
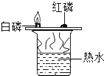
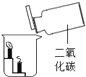
A.甲烷燃烧生成二氧化碳和水 | B.铁能在氧气中燃烧 | C.白磷的着火点比红磷的低 | D.二氧化碳的密度比空气大,不燃烧也不支持燃烧 |
A. A B. B C. C D. D