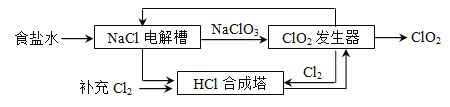
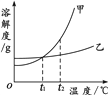
题目内容
【题目】根据下表回答相关问题。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g/100g水) | KNO3 | 13.3 | 31.6 | 63.9 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
①表中两种物质的溶解度相等的温度范围是在___________℃。
②20℃时,硝酸钾的溶解度是31.6 g/100g水,其含义是___________。该温度下,将20gKNO3
放入50g水中,充分搅拌,所得溶液的质量是_______g。要进一步提高该溶液的溶质质量分数,可进行的操作是__________。
③硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是_________ 。
④60℃时,对100g硝酸钾饱和溶液(如A烧杯)进行如下操作,请回答相关问题:
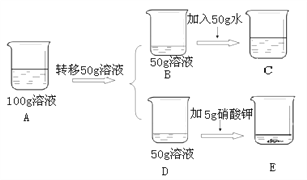
上述溶液中所含溶质的质量D_____E(填“>”或“<”或“=”,下同),溶液不饱和的是___(用A、B、C、D、E填空),溶液B、C、E中溶质质量分数的大小关系是__________。
【答案】 20-40℃ 20℃100g水中溶解31.6g硝酸钾达到饱和 65.8 加热 冷却热饱和溶液 = C B=E>C
【解析】①由表格信息可知,在20-40℃的某一温度时氯化钠和硝酸钾的溶解度相等;②溶解度指的是在某温度时,向100g溶剂中加入某溶质达到饱和状态所溶解的质量,故20℃时,硝酸钾的溶解度是31.6 g/100g水,其含义是20℃100g水中溶解31.6g硝酸钾达到饱和;20gKNO3的溶解度为31.6g,将20gKNO3放入50g水中,充分搅拌,只能溶解15.8g,故所得溶液的质量为65.8g;要进一步提高该溶液的溶质质量分数,即要使未溶解的硝酸钾继续溶解,那么要增大硝酸钾的溶解度,可以采用升温的方法;③硝酸钾的溶解度随温度的变化变化较大,故要提纯硝酸钾可采用降温结晶的方法;④D是60℃时硝酸钾的饱和溶液,那么继续加入硝酸钾,硝酸钾不能溶解,溶质的质量不变,即D和E所含的溶质质量相等;B是60℃时硝酸钾的饱和溶液,加入50g水后变成不饱和溶液,那么B的溶质质量分数大于C的溶质质量分数;由于E和D的溶质质量分数相等,那么E和B的溶质质量分数也相等,故溶液B、C、E中溶质质量分数的大小关系是B=E>C 。

【题目】利用图1装置进行I、II两组实验,将滴管a中的液体滴入b中,待充分作用后,打开止水夹d。a、b、c中所加试剂如下表所示。
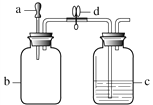
图1
实验 | a中试剂 | b中试剂 | c中试剂 |
I | 5%H2O2溶液 | MnO2 | 80 ℃热水 |
II | 石蕊溶液 | HCl气体 | NaOH溶液 |
已知:HCl气体极易溶解于水。白磷的着火点为40 ℃。
(1)实验I中,若在c中长导管口处放置一块白磷,当打开止水夹后,可观察到白磷燃烧,通过此实验能证明燃烧的条件是________。 若要证明燃烧的另一条件,在对比实验中,需将c中盛放的试剂改为________。
(2)实验II能证明NaOH与HCl发生了反应。实验过程中,打开止水夹d后,可观察到的现象为________。
(3)若按图2所示连接装置,进行实验II,则会观察到c中长导管口有气泡产生,原因是________。

图2