题目内容
18.气体的制备是初中化学重要知识和技能,下列是某同学对气体制取装置的研究.请你跟他一同解决下列问题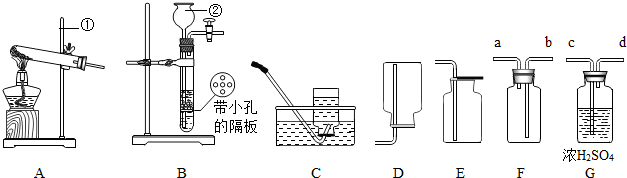
(1)写出下列仪器名称:①铁架台,②长颈漏斗.
(2)实验室利用A装置制取氧气,反应原理用化学方程式表示为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(3)用B装置制取二氧化碳,选择该套装置制取气体的突出优点是可控制反应的发生和停止.若用F装置收集氢气,则气体应从a端进入.
(4)制得的二氧化碳气体中常含有少量的水蒸气,欲用G装置除去水蒸气,应将气体从c端进入.
分析 (1)据常用仪器回答;
(2)A装置适用于加热固体制取气体,且试管口无棉花,说明是用加热氯酸钾的方法制取氧气,据反应原理书写方程式;
(3)装置B可通过弹簧夹的开闭随时控制反应的发生和停止,氢气的密度比空气小,所以应从a导管进气;
(4)浓硫酸具有吸水性.
解答 解:(1)编号仪器分别是铁架台、长颈漏斗;
(2)A装置适用于加热固体制取气体,且试管口无棉花,说明是用加热氯酸钾的方法制取氧气,方程式是:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(3)使用该套装置制取气体可通过弹簧夹的开闭随时控制反应的发生和停止;
故答案为:
(1)①铁架台; ②长颈漏斗;
(2)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(3)可以随时控制反应发生或停止、a;
(4)c.
点评 据反应物状态和反应条件选择发生装置,据气体的密度和溶解性选择收集装置,并熟悉实验室制取氧气和二氧化碳的反应原理,掌握二氧化碳的性质等知识才能依据选项正确分析解答.

练习册系列答案
相关题目
8.下列属于纯净物的是( )
| A. | 碘酒 | B. | 食醋 | C. | 软水 | D. | 金刚石 |
9.下列说法属于化学性质的是( )
| A. | 铝能导电 | B. | 金刚石硬度最大 | ||
| C. | 氧气常温下呈气态 | D. | 铁钉会生锈 |
6.下列物质鉴别方法错误的是( )
| 标号 | A | B | C | D |
| 待鉴别的物质 | 铁粉与氧化铜 | 浓盐酸与浓硫酸 | 氮气与氧气 | 羊毛与涤纶 |
| 鉴别方法 | 观察颜色 | 打开瓶盖后观察 | 带火星的木条 | 灼烧后闻气味 |
| A. | A | B. | B | C. | C | D. | D |
13.通过对下列有关化学反应的归纳,结论正确的是( )
| A. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,碳燃烧一定产生CO2 | |
| B. | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,属于置换反应 | |
| C. | 2HCl+Fe═FeCl2+H2↑,铁桶不能装盐酸 | |
| D. | NaOH+HCl═NaCl+H2O,氢氧化钠可以治疗胃酸过多 |
3.下列变化过程中只发生了物理变化的是( )
| A. | 动植物呼吸 | B. | 食醋除水垢 | C. | 干冰升华 | D. | SO2形成酸雨 |
6.某同学对一瓶长期暴漏在空气中的氢氧化钠固体样品的成分及含量进行探究.
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液汇总几乎不溶解.
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
【提出问题2】怎样提纯该样品得到纯净的氢氧化钠固体?
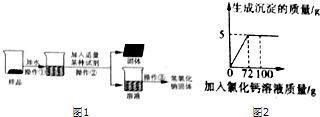
【实验探究2】为得到纯净的氢氧化钠固体,小亮明设计了如图1所示的实验流程.请回答下列问题:
(1)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)最终所得氢氧化钠固体质量大于(填“大于”、“等于”或“小于”)变质后样品中氢氧化钠的质量.
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质和除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考的问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差.
(2)向50g Na2co3溶液总逐滴加入一定溶质质量分数的CaCl2溶液,实验过程中,生成沉淀的质量与加入CaCl2溶液的质量关系如图所示,试计算:恰好完全反应时,所得溶液中溶质的质量分数.
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液汇总几乎不溶解.
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入 过量CaCl2溶液; | 白色沉淀产生 | 该反应的化学方程式:Na2CO3+CaCl2═2NaCl+CaCO3↓ |
| (2)将上述反应后的混合液过滤,取滤液加入酚酞试液; | 溶液变红色 | 证明猜想Ⅱ正确 |
【实验探究2】为得到纯净的氢氧化钠固体,小亮明设计了如图1所示的实验流程.请回答下列问题:
(1)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)最终所得氢氧化钠固体质量大于(填“大于”、“等于”或“小于”)变质后样品中氢氧化钠的质量.
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质和除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考的问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差.
(2)向50g Na2co3溶液总逐滴加入一定溶质质量分数的CaCl2溶液,实验过程中,生成沉淀的质量与加入CaCl2溶液的质量关系如图所示,试计算:恰好完全反应时,所得溶液中溶质的质量分数.

