题目内容
【题目】化学与生活息息相关,我们的衣食住行都离不开化学。
(1)煤块燃烧时,将煤块粉碎成煤粉是为了使煤与空气_____。
(2)上海世博会的主题是“城市,让生活更美好”。世博园内使用电动车,有效地减少了二氧化碳、二氧化硫、一氧化碳的排放,这些物质中会引起温室效应的是__;造成酸雨的是____。
(3)二氧化钛(TiO2)可制作用于家装的白色涂料,其中Ti的化合价为_____。
(4)汽车是重要的交通工具。
①汽车使用天然气作燃料,排放污染较低。天然气的主要成分为____。
②完成车用铅酸电池充电的反应:2PbSO42H2O ![]() Pb2H2SO4+(_____)。
Pb2H2SO4+(_____)。
【答案】充分接触 二氧化碳 二氧化硫 +4 甲烷 ![]()
【解析】
(1)煤块燃烧时,将煤块粉碎成煤粉是为了使煤与空气充分接触。
(2)二氧化碳、二氧化硫、一氧化碳的排放,这些物质中会引起温室效应的是二氧化碳;造成酸雨的是二氧化硫。
(3)二氧化钛(![]() )中,根据化合物中各元素化合价代数和为零,设Ti的化合价为x,则
)中,根据化合物中各元素化合价代数和为零,设Ti的化合价为x,则![]() ,x=+4。
,x=+4。
(4)①天然气的主要成分为甲烷。
②根据质量守恒定律,括号物质包含1个![]() 原子、2个
原子、2个![]() 原子,故括号应填
原子,故括号应填![]() 。
。

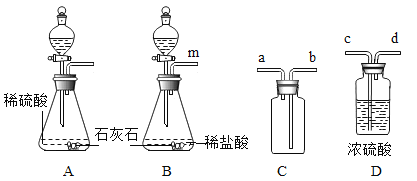
【题目】请通过下列四组实验,回答相关问题:
甲 | 乙 | 丙 | 丁 |
|
|
|
|
铁丝燃烧 | 测定水的元素组成 | 煅烧石灰石 | 测定空气中氧气体积分数 |
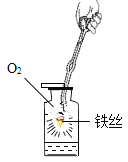
(1)实验甲中,铁丝在氧气中燃烧的现象是_____,反应的化学方程式_____;该实验瓶底 留少量水的目的是_____。
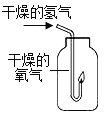
(2)实验乙中,观察到集气瓶内壁有_____产生,也可以得出结论。氢气燃烧的化学方程式_____。
(3)实验丙中,观察到烧杯内壁石灰水变浑浊,写出产生此现象的反应的化学方程式_____。实验结论:说明石灰石已分解。该实验设计是否合理,理由是_____。
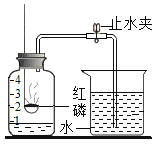
(4)实验丁中,红磷燃烧的化学方程式是_____,冷却到室温,打开止水夹,观察到的现象是_____。若测定氧气的体积分数偏小,可能的原因是_____。
【题目】下图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点
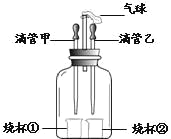
(1)若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到无 色酚酞溶液变红,说明分子具有的性质是____。
(2)若甲中吸有水,乙中吸有稀盐酸,烧杯①中盛有用石蕊试液染成紫色的干燥纸花,烧杯②中盛有碳 酸钙粉末。为了验证使石蕊变色的物质是碳酸而不是二氧化碳,应采取的实验操作是____。
(3)若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球 又明显鼓起。请将下表中的试剂补充完整。
滴管甲 | 烧杯① | 滴管乙 | 烧杯② | |
试剂 | H2O | ____ | ____ | Mg |
气球鼓起是因为装置内气压增大,两次气压增大的原因依次是_____。
【题目】学习金属化学性质时,小红同学对“锌与硫酸反应快慢的影响因素”进行了探究。锌与硫酸反应的化学方程式是_____。
(提出问题)锌与硫酸反应的快慢受哪些因素的影响呢?
(猜想与假设)a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
(设计并实验)小红用不同质量分数的硫酸和不同形状的锌进行下表所示实验。
实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积/mL(均集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(收集证据)
(1)比较不同形状的锌对反应快慢的影响,选拌的实验编号是_____。
(2)比较不同质量分数的硫酸对反应快慢的影响,选择的实验编号是_____。
(得出结论)结论是①_____;②_____。
(评价与反思)
(l)下表是小组同学第①组实验的详细数据。
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 6.0mL |
第2分钟以后反应变慢是因为______________。
(2)实验结束发现实验用的试管内有白色晶体,显然不是剩余的锌,它应该是_____,产生这些白色晶体的原因是_____。