题目内容
【题目】下列设计方案合理且化学方程式书写正确的是
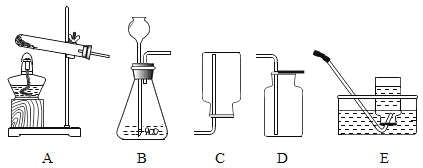
A. 证明金属活动性Mg![]() Ag:Mg
Ag:Mg![]() 2AgCl2MgCl2
2AgCl2MgCl2![]() Ag
Ag
B. 用硝酸钡区别氢氧化钠和硫酸钾:K2SO4![]() Ba(NO3)2BaSO4↓
Ba(NO3)2BaSO4↓![]() KNO3
KNO3
C. 用稀硫酸除去炭粉中的少量氧化铜:CuO![]() H2SO4CuSO4
H2SO4CuSO4![]() H2O
H2O
D. 用氢氧化钙治疗胃酸过多症:Ca(OH)2![]() 2HClCaCl2
2HClCaCl2![]() 2H2O
2H2O
【答案】C
【解析】
A、溶于水的盐才能与金属活动性更强的金属单质反应,氯化银不溶于水,所以镁与氯化银不能反应,选项错误;
B、硝酸钡与氢氧化钠不发生反应,但能与硫酸钾反应生成硝酸钠和硫酸钡沉淀,反应的化学方程式为:K2SO4![]() Ba(NO3)2BaSO4↓
Ba(NO3)2BaSO4↓![]() 2KNO3,选项错误;
2KNO3,选项错误;
C、硫酸与碳不能发生化学反应,但硫酸能与氧化铜反应生成硫酸铜和水,反应的化学方程式为:CuO![]() H2SO4CuSO4
H2SO4CuSO4![]() H2O,选项正确;
H2O,选项正确;
D、氢氧化钙具有腐蚀性,不能用于治疗胃酸过多,治疗胃酸过多应选用氢氧化铝,选项错误,故选C。

【题目】溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是___________。
A 只有固体 B 只有液体
C 只有气体 D 气体、液体、固体都可以
(2)配制100g质量分数为16%的氯化钠溶液,所需氯化钠的质量为___________,水的体积为_________mL (水的密度近似看作lg/cm3)。
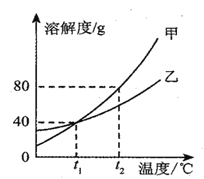
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如下图.t1℃时,甲物质的溶解度是___________。t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是___________ (填“甲”或“乙”)物质的饱和溶液。
(4)下列说法正确的是___________。
A.将甲物质的饱和溶液变为不饱和溶液,其溶质的质量分数一定减小
B.将t2℃时甲、乙物质的溶液降温到t1℃,其溶液的质量一定相等
C.配制一定溶质质量分数的乙物质溶液,若量取水时俯视读数,其它操作均正确,则配制的乙溶液中溶质的质量分数将偏高
选项 | x | y |
A | 水 | 氧化钙 |
B | 水 | 硝酸铵 |
C | 浓硫酸 | 水 |
D | 稀盐酸 | 镁 |
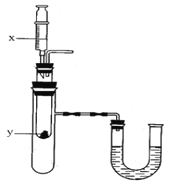
(5)按上图所示装置,将液体X注入装有固体y的试管中,会导致U形管中右端液面升高。则可能的组合是______________________。
【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 除去 | 点燃 |
B | 区别硬水和软水 | 肥皂水 |
C | 鉴别氢气和甲烷 | 分别点燃,火焰上罩干冷烧杯 |
D | 除去硫酸亚铁溶液中的少量硫酸铜 | 加入足量铁粉,过滤 |
A. AB. BC. CD. D