题目内容
 某探究小组的同学对金属的性质很感兴趣,进行了如下探究.
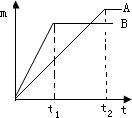
某探究小组的同学对金属的性质很感兴趣,进行了如下探究.(1)探究金属的活泼性.取等质量的A、B金属,分别投入溶质质量分数相同的足量的盐酸中,生成氢气的质量(m)与时间(t)的关系如图.(已知A、B元素在生成物中的化合价相同)
①由图分析,甲、乙、丙三位同学的对话正确的是
甲:时间t1时,产生氢气的质量A<B
乙:到时间t2时,金属均有剩余
丙:两种金属原子的相对原子质量A<B
②结论:金属A、B的活泼性
(2)测定铜锌合金中铜的质量分数.向质量为26.0g的铜锌合金中滴入10%的稀硫酸98.0g时,恰好完全反应不再产生氢气.求
①生成氢气的质量.
②合金中铜的质量分数.
分析:(1)①时间线与曲线的交点高表示生成的氢气多,交点低表示生成的氢气少;
时间为t1时B的曲线随时间推移已经保持水平,说明B金属已经完全反应,没有剩余;
曲线保持水平时A高B低,说明A的相对原子质量比B小.
②反应掉相同质量金属,B用时间短,说明B比A活泼.
(2)①由稀硫酸的质量和质量分数根据锌与硫酸反应的化学方程式可以计算出生成氢气的质量;
②同时还能计算出合金中铜的质量分数.
时间为t1时B的曲线随时间推移已经保持水平,说明B金属已经完全反应,没有剩余;
曲线保持水平时A高B低,说明A的相对原子质量比B小.
②反应掉相同质量金属,B用时间短,说明B比A活泼.
(2)①由稀硫酸的质量和质量分数根据锌与硫酸反应的化学方程式可以计算出生成氢气的质量;
②同时还能计算出合金中铜的质量分数.
解答:解:(1)①时间线与B曲线的交点高表示时间t1时B比A生成的氢气多,故甲正确;
时间为t1时B的曲线随时间推移已经保持水平,说明B金属已经完全反应,没有剩余,故乙错误;
曲线保持水平时A高B低,说明A的相对原子质量比B小,故丙正确.
②反应掉相同质量金属,B用时间短,说明B比A活泼.
(2)设生成氢气的质量为x,合金中铜的质量分数为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
26.0g?(1-y) 98.0g×10% x
=
=
x=0.2g,y=75%
答:(1)①甲、丙;②B比A活泼.
(2)①生成氢气0.2g,
②合金中铜的质量分数为75%.
时间为t1时B的曲线随时间推移已经保持水平,说明B金属已经完全反应,没有剩余,故乙错误;
曲线保持水平时A高B低,说明A的相对原子质量比B小,故丙正确.
②反应掉相同质量金属,B用时间短,说明B比A活泼.
(2)设生成氢气的质量为x,合金中铜的质量分数为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
26.0g?(1-y) 98.0g×10% x
| 65 |
| 26.0g?(1-y) |
| 98 |
| 98.0g×10% |
| 2 |
| x |
x=0.2g,y=75%
答:(1)①甲、丙;②B比A活泼.
(2)①生成氢气0.2g,
②合金中铜的质量分数为75%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2010年7月3日,紫金矿业位于福建上杭县的紫金山铜矿湿法厂发生污水渗漏事故,9100立方米废水外渗引发福建汀江流域污染,造成沿江上杭、永定出现鱼类死亡和水 质污染现象.某校化学兴趣小组的同学对河水取样,欲探究其酸碱性并想出处理措施.
2010年7月3日,紫金矿业位于福建上杭县的紫金山铜矿湿法厂发生污水渗漏事故,9100立方米废水外渗引发福建汀江流域污染,造成沿江上杭、永定出现鱼类死亡和水 质污染现象.某校化学兴趣小组的同学对河水取样,欲探究其酸碱性并想出处理措施.
(1)设计方案探究河水的酸碱性
| 所需药品或试剂 | 步骤或方法 | 可能观察到的现象 | 得出结论 |
| ______ | ______ | ______ | 河水呈酸性 |
(3)点点同学提出问题:怎么知道河水恰好被中和?小武同学回忆:我们学习酸碱中和时,化学老师借助了酸碱指示剂,你知道酸碱指示剂在中和反应时所起的作用吗?______.
(4)为防治水污染,你有什么建议?______.
2010年7月3日,紫金矿业位于福建上杭县的紫金山铜矿湿法厂发生污水渗漏事故,9100立方米废水外渗引发福建汀江流域污染,造成沿江上杭、永定出现鱼类死亡和水 质污染现象.某校化学兴趣小组的同学对河水取样,欲探究其酸碱性并想出处理措施.
(1)设计方案探究河水的酸碱性
(2)经环保部门测定,污水中含硫酸等物质,小文同学认为可往河水中投入______以减轻污染,试写出其中一个反应的化学方程式______.
(3)点点同学提出问题:怎么知道河水恰好被中和?小武同学回忆:我们学习酸碱中和时,化学老师借助了酸碱指示剂,你知道酸碱指示剂在中和反应时所起的作用吗?______.
(4)为防治水污染,你有什么建议?______.
(1)设计方案探究河水的酸碱性
| 所需药品或试剂 | 步骤或方法 | 可能观察到的现象 | 得出结论 |
| ______ | ______ | ______ | 河水呈酸性 |
(3)点点同学提出问题:怎么知道河水恰好被中和?小武同学回忆:我们学习酸碱中和时,化学老师借助了酸碱指示剂,你知道酸碱指示剂在中和反应时所起的作用吗?______.
(4)为防治水污染,你有什么建议?______.

 2010年7月3日,紫金矿业位于福建上杭县的紫金山铜矿湿法厂发生污水渗漏事故,9100立方米废水外渗引发福建汀江流域污染,造成沿江上杭、永定出现鱼类死亡和水 质污染现象.某校化学兴趣小组的同学对河水取样,欲探究其酸碱性并想出处理措施.
2010年7月3日,紫金矿业位于福建上杭县的紫金山铜矿湿法厂发生污水渗漏事故,9100立方米废水外渗引发福建汀江流域污染,造成沿江上杭、永定出现鱼类死亡和水 质污染现象.某校化学兴趣小组的同学对河水取样,欲探究其酸碱性并想出处理措施. 金属与人类的生活和生产密切相关.
金属与人类的生活和生产密切相关.