题目内容
某小组同学准备用生石灰制取氢氧化钠,并验证产物.他们将少量生石灰放入烧杯中,向其中加入一定量碳酸钠溶液,振荡,充分反应,冷却后过滤得到固体A和溶液B.
(1)其原理用化学方程式表示为 .
(2)甲同学取少量固体A于试管中并滴加稀盐酸,有气体产生.据此他判断固体A中只有碳酸钙.小组同学讨论后,认为甲同学的实验不能证明A中只有碳酸钙,理由是 ,若要证明A中只有碳酸钙,操作为 .
(3)探究溶液B中溶质的成分.
【猜想与假设】乙同学猜想为:NaOH、Na2CO3
丙同学猜想为:NaOH、Ca(OH)2
丁同学猜想为:Na2CO3
你的猜想为: ,作为猜想的理由是 .
【实验与探究】若要设计实验证明乙同学的猜想正确,请将相关内容填入表3.
【分析与讨论】若丙同学的猜想正确,为计算反应中消耗CaO的质量,丙认为:利用B溶液中通入过量CO2生成沉淀的质量与固体A的质量之和即可推算出消耗CaO的质量.你认为是否可行? ,理由是 .
【拓展与归纳】由本题涉及的实验能总结出的盐的化学性质有 .
(1)其原理用化学方程式表示为
(2)甲同学取少量固体A于试管中并滴加稀盐酸,有气体产生.据此他判断固体A中只有碳酸钙.小组同学讨论后,认为甲同学的实验不能证明A中只有碳酸钙,理由是
(3)探究溶液B中溶质的成分.
【猜想与假设】乙同学猜想为:NaOH、Na2CO3
丙同学猜想为:NaOH、Ca(OH)2
丁同学猜想为:Na2CO3
你的猜想为:
【实验与探究】若要设计实验证明乙同学的猜想正确,请将相关内容填入表3.
| 实验步骤 | 实验现象 | 实验结论 |
【拓展与归纳】由本题涉及的实验能总结出的盐的化学性质有
考点:实验探究物质的组成成分以及含量,生石灰的性质与用途,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:(1)根据生石灰和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成氢氧化钠和碳酸钙沉淀去分析判断;(2)由于稀盐酸和碳酸钙反应能产生二氧化碳气体,而稀盐酸和氢氧化钙反应生成氯化钙和水去分析判断;
【猜想与假设】根据由(1)中化学方程式可以看出,反应物和生成物中能溶于水的有:氢氧化钠、碳酸钠和氢氧化钙(微溶),所以溶液B中的成分,只能是这几种物质的组合去分析判断;
【实验与探究】若想证明溶液中有NaOH、Na2CO3,由于二者的溶液都显碱性,所以要想证明溶液中含有氢氧化钠,就要先除去溶液中的碳酸钠.
【分析与讨论】根据A中还可能含有氢氧化钙,不全部是碳酸钙去分析判断;
【拓展与归纳】根据(1)中碳酸钠和氢氧化钙的反应,可以看出盐可以和碱反应;从【实验与探究】中碳酸钠和氯化钙反应可以看出盐可以和盐反应去分析判断.
【猜想与假设】根据由(1)中化学方程式可以看出,反应物和生成物中能溶于水的有:氢氧化钠、碳酸钠和氢氧化钙(微溶),所以溶液B中的成分,只能是这几种物质的组合去分析判断;
【实验与探究】若想证明溶液中有NaOH、Na2CO3,由于二者的溶液都显碱性,所以要想证明溶液中含有氢氧化钠,就要先除去溶液中的碳酸钠.
【分析与讨论】根据A中还可能含有氢氧化钙,不全部是碳酸钙去分析判断;
【拓展与归纳】根据(1)中碳酸钠和氢氧化钙的反应,可以看出盐可以和碱反应;从【实验与探究】中碳酸钠和氯化钙反应可以看出盐可以和盐反应去分析判断.
解答:解:(1)生石灰和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成氢氧化钠和碳酸钙沉淀,发生反应的化学方程式为:CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;故答案为:CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(2)由于稀盐酸和碳酸钙反应能产生二氧化碳气体,而稀盐酸和氢氧化钙反应生成氯化钙和水,所以加入稀盐酸有气泡只能证明有CaCO3,不能证明有无Ca(OH)2;碱溶液遇到酚酞试液显红色,取少量固体于试管中,加水充分振荡,过滤,向滤液中滴加酚酞溶液,溶液不变色,说明溶液中没有氢氧化钙;
故答案为:加入稀盐酸有气泡只能证明有CaCO3,不能证明有无Ca(OH)2 取少量固体于试管中,加水充分振荡,过滤,向滤液中滴加酚酞溶液不变色;
【猜想与假设】由(1)中化学方程式可以看出,反应物和生成物中能溶于水的有:氢氧化钠、碳酸钠和氢氧化钙(微溶),所以溶液B中的成分,只能是这几种物质的组合,如果反应中氢氧化钙和碳酸钠恰好完全反应,则溶液B中就只有氢氧化钠;故答案为:氢氧化钠 氢氧化钙和碳酸钠恰好完全反应;
【实验与探究】若想证明溶液中有NaOH、Na2CO3,由于二者的溶液都显碱性,所以要想证明溶液中含有氢氧化钠,就要先除去溶液中的碳酸钠.向溶液中加入过量(使溶液中的碳酸钠溶液反应)的氯化钙溶液(溶液呈中性),生成碳酸钙沉淀和氯化钠;然后向溶液中滴加酚酞溶液,氢氧化钠是碱,能使酚酞变红;
故答案为:取溶液B少许,加入过量的氯化钙溶液,滴加酚酞溶液 生成白色沉淀,溶液变红 溶液B的成分为NaOH、Na2C3;
【分析与讨论】由于A中还可能含有氢氧化钙,不全部是碳酸钙,所以不能根据利用B溶液中通入过量CO2生成沉淀的质量与固体A的质量之和即可推算出消耗CaO的质量;故答案为:不行 A中可能含有氢氧化钙;
【拓展与归纳】由(1)中碳酸钠和氢氧化钙的反应,可以看出盐可以和碱反应;从【实验与探究】中碳酸钠和氯化钙反应可以看出盐可以和盐反应;故答案为:盐和碱反应,盐和盐反应.
(2)由于稀盐酸和碳酸钙反应能产生二氧化碳气体,而稀盐酸和氢氧化钙反应生成氯化钙和水,所以加入稀盐酸有气泡只能证明有CaCO3,不能证明有无Ca(OH)2;碱溶液遇到酚酞试液显红色,取少量固体于试管中,加水充分振荡,过滤,向滤液中滴加酚酞溶液,溶液不变色,说明溶液中没有氢氧化钙;
故答案为:加入稀盐酸有气泡只能证明有CaCO3,不能证明有无Ca(OH)2 取少量固体于试管中,加水充分振荡,过滤,向滤液中滴加酚酞溶液不变色;
【猜想与假设】由(1)中化学方程式可以看出,反应物和生成物中能溶于水的有:氢氧化钠、碳酸钠和氢氧化钙(微溶),所以溶液B中的成分,只能是这几种物质的组合,如果反应中氢氧化钙和碳酸钠恰好完全反应,则溶液B中就只有氢氧化钠;故答案为:氢氧化钠 氢氧化钙和碳酸钠恰好完全反应;
【实验与探究】若想证明溶液中有NaOH、Na2CO3,由于二者的溶液都显碱性,所以要想证明溶液中含有氢氧化钠,就要先除去溶液中的碳酸钠.向溶液中加入过量(使溶液中的碳酸钠溶液反应)的氯化钙溶液(溶液呈中性),生成碳酸钙沉淀和氯化钠;然后向溶液中滴加酚酞溶液,氢氧化钠是碱,能使酚酞变红;
故答案为:取溶液B少许,加入过量的氯化钙溶液,滴加酚酞溶液 生成白色沉淀,溶液变红 溶液B的成分为NaOH、Na2C3;
【分析与讨论】由于A中还可能含有氢氧化钙,不全部是碳酸钙,所以不能根据利用B溶液中通入过量CO2生成沉淀的质量与固体A的质量之和即可推算出消耗CaO的质量;故答案为:不行 A中可能含有氢氧化钙;
【拓展与归纳】由(1)中碳酸钠和氢氧化钙的反应,可以看出盐可以和碱反应;从【实验与探究】中碳酸钠和氯化钙反应可以看出盐可以和盐反应;故答案为:盐和碱反应,盐和盐反应.
点评:本题综合性较强,考查学生对碳酸钠的检验和除去方法理解与应用及灵活运用进行分析问题、解决问题的能力.

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
人类生活需要能量,下列能量主要由化学变化产生的是( )
| A、电灯通电发出的光 |
| B、天然气燃烧放出的热量 |
| C、电褥子通电放出的热量 |
| D、水电站用水力产生的电能 |
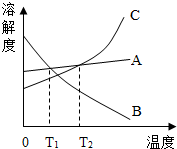 如图所示是A、B、C三种物质的溶解度曲线图.
如图所示是A、B、C三种物质的溶解度曲线图.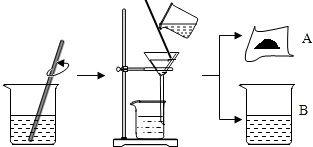 将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学学习小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B.操作步骤如图所示.小组同学对固体A、溶液B进行如下猜想与探究:
将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学学习小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B.操作步骤如图所示.小组同学对固体A、溶液B进行如下猜想与探究: 请按要求填空:
请按要求填空: