题目内容
【题目】化学兴趣小组对某品牌牙膏中碳酸钙含量进行以下探究。该牙膏摩擦剂主要由碳酸钙、氢氧化铝组成,其他成分遇到盐酸时无气体生成。现利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。请回答下列问题。(已知:碱石灰固体的主要成分是生石灰和烧碱)

(1)装置A中牙膏样品放置在_______(填仪器名称)中,盐酸放置在装置______(填仪器名称)中,A中至少发生___(填数字)个反应,写出其中一个反应的化学方程式______
(2)若测定值比实际值小,可能的原因有________________(填字母)
a.装置A中水蒸气、HCl等进入装置B中
b.装置A中CO2未完全进入装置B
c.CO2气流速度太快导致Ba(OH)2未完全吸收
d.盐酸未滴加过量
(3)为减少误差,现采取以下一些措施:
①在A、B之间增加一个装有_____(填化学式)溶液的洗气瓶,它的作用是___;
②若将装置B中的长导管下方增加一个多孔球泡,作用是___;
③若将装置A的前面再增加一个鼓入氮气的装置,目的是_____________;
④若在装置B的后面再增加一个装有碱石灰固体的干燥管,目的是___________________
(4)准确称取三份各16.00g的样品,进行测定,测得BaCO3质量分别为3.96g、3.92g、3.94g。请计算样品中碳酸钙的质量分数。(写出计算过程)_______
(5)某同学利用上述方法测定牙膏中钙元素的质量分数。小李同学认为即使即使排除实验仪器和操作的影响,上述测定的结果仍有可能偏小,理由是:
_______。
【答案】 锥形瓶 分液漏斗 2 略 bcd 硝酸银 吸收HCl,防止进入B装置 增大接触面积,提高吸收效率 使残留在装置内的CO2完全进入装置B,被充分吸收 吸收空气中的二氧化碳防止进入装置B(只答吸水吸二氧化碳不得分,至少答到吸收空气中的二氧化碳) 12.5%
CO2= 0.88g CaCO3 =2g CaCO3%=12.5% 牙膏中可能含有其他含钙物质
【解析】(1)装置A中牙膏样品放置在锥形瓶中,盐酸放置在装置分液漏斗中,A中氢氧化钙和碳酸钙都可以和稀盐酸固液,故至少发生2个反应,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,反应方程式为CaCO3+2HCl == CaCl2+H2O+CO2↑;
(2)a、当有水和盐酸进入时,应该和氢氧化钡反应,不能和碳酸钡反应,故不能影响,错误;b、装置A中CO2未完全进入装置B,会使生成的碳酸钡沉淀的质量减少,故结果偏小,正确;c、CO2气流速度太快导不能和Ba(OH)2完全反应,可能导致结果偏小,正确;
d、盐酸未滴加过量可能使碳酸钙不能完全反应,故结果偏小,正确,故选bcd;
(3)①在A、B之间增加一个装置,要能除去盐酸,但不与二氧化碳反应,也不生成二氧化碳,故选硝酸银;它的作用是吸收HCl,防止进入B装置;②若将装置B中的长导管下方增加一个多孔球泡,作用是增大接触面积,提高吸收效率;③若将装置A的前面再增加一个鼓入氮气的装置,目的是使残留在装置内的CO2完全进入装置B,被充分吸收;④若在装置B的后面再增加一个装有碱石灰固体的干燥管,目的是吸收空气中的二氧化碳防止进入装置B;
(4)三次测量结果的平均值为3.94g。故生成碳酸钡的质量为3.94g;设样品中碳酸钙的质量为x
CaCO3------------BaCO3
100 197
X 3.94
![]() =
=![]() 得x=2g
得x=2g
16g样品中碳酸钙的质量分数为![]() =12.5%;
=12.5%;
(5)牙膏中的其他物质可能影响实验结果;

【题目】同学们通过学习金属后,对铜的化学性质进行了进一步的研究。
项目一. 同学们将光亮铜片放在酒精灯火焰上灼烧,发现表面变黑,他们对黑色物质来源产生了兴趣,铜片表面黑色物质是什么呢?
【查阅资料】
(1)酒精不充分燃烧产生炭黑(即黑烟);
(2)氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
(3)氧化铜能与硫酸反应生成硫酸铜和水;炭黑难溶于水,且与硫酸不发生反应。
【猜想与假设】
猜想1:黑色固体是炭黑。
猜想2:黑色固体是空气中的氧气与铜反应生成的氧化铜。
猜想3:黑色固体既有炭黑又有氧化铜。
【进行实验】
实验步骤和方法 | 实验现象 | 实验结论 |
实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热。 | 铜片变黑 | (1)猜想1不正确。 (2)黑色固体可能与空气中的 ______ 有关。 |
实验二:取一试管,将一小段光亮铜片放入试管中,塞上胶塞,并用注射器抽出试管内的空气,封好胶塞,并加热,观察现象。趁热取下胶塞,观察现象。 | ________ | 猜想2正确 |
实验三:将在酒精灯火焰上灼烧后的附着黑色固体的铜片,投入到盛有稀硫酸的试管中。 | ________ | 猜想3不正确 |
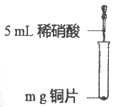
项目二. 同学们通过学习知道铜与盐酸、稀硫酸不能发生反应,但却发现化学老师用铜与硝酸制备出气体去做物理实验。同学们在实验室对铜与稀硝酸的反应进行了探究。
实验I | |
实验装置 | 实验现象 |
| 铜片逐渐消失, 有无色气泡产生,试管中上部有红棕色气体出现; 溶液由无色变为蓝色 |
【探究】实验I中产生的无色气体是什么?
【查阅资料】
(1)硝酸(HNO3)与Cu反应生成硝酸铜和含氮元素的化合物;硝酸铜溶液呈蓝色;
(2)氨气(NH3)可以使酚酞溶液变红
(3)含氮元素的某些气态物质的物理性质
NH3 | NO | NO2 | |
颜色 | 无色 | 无色 | 红棕色 |
气味 | 刺激性 | 刺激性 | |
溶解性 | 极易溶于水 | 难溶于水 | 可溶于水或硝酸 |
【猜想与假设】无色气体可能是:①NH3 ②NO
【进行实验】同学们利用下图装置对产生的无色气体进行检验。
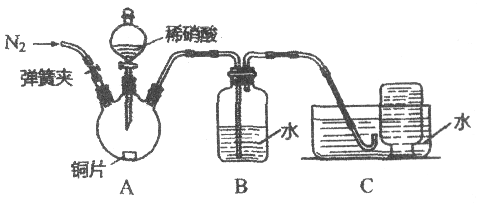
实验操作 | 实验现象 |
1. 打开弹簧夹,通入N2,一段时间后,关闭弹簧夹 | B、C中导管口有无色气泡冒出 |
2. 将C中导管伸入集气瓶中,打开分液漏斗的活塞,滴入一定量稀硝酸,关闭活塞 | A中有无色气泡产生 B中导管口有无色气泡冒出 C中集气瓶内收集到无色气体 |
3. 从水槽中取出集气瓶,敞口置于空气中 | 无色气体变为红棕色 |
4. 取少量B中液体于试管中,滴加无色酚酞溶液 | 试管中溶液颜色无明显变化 |
【解释与结论】
(1)操作1中,通入N2的目的是__________。
(2)同学们认为猜想①不正确,理由是__________。
(3)无色气体具有的化学性质是__________。