题目内容
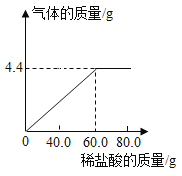
【题目】(双选)下列图形能正确反映实验事实的是
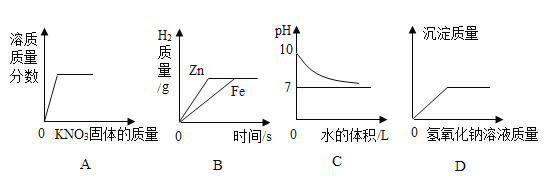
A.向接近饱和的KNO3溶液中加入KNO3固体
B.足量的Zn、Fe分别与等质量等质量分数的稀硫酸反应
C.常温下向pH=10的氢氧化钠溶液中加水稀释
D.向硫酸铜和硫酸混合液中滴入氢氧化钠溶液
【答案】BC
【解析】
A、在一定温度下,向一定质量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体,则图像中溶液质量分数不能从0开始,故A错误;
B、足量的Zn,Fe分别与等质量等质量分数的稀硫酸反应时,生成氢气的质量决定于稀疏酸的质量,因为是和等质量等质量分数的稀硫酸反应,因此生成氢气的质量相等;锌的活动性强于铁,锌和稀硫酸反应需要的时间较短,该选项对应关系正确,故B正确;
C、常温下向pH=10的碱酸溶液中加水稀释,碱性减弱,pH逐渐接近7,故C正确;
D、向硫酸铜和稀硫酸的混合溶液中不断加氢氧化钠溶液,则氢氧化钠先和硫酸反应,当硫酸消耗尽,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀,沉淀不会从零开始,故D错误。故选BC。

 阅读快车系列答案
阅读快车系列答案【题目】根据下表回答问题。
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g 水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)上表中的三种物质在20℃时,___________的溶解度最大;
(2)将40 ℃时NH4Cl和NaCl的两种饱和溶液升温至60 ℃,则两种溶液的溶质质量分数大小关系是:NaCl_____NH4Cl(填写“>”、“<”或“=”)。
(3)饱和KNO3 溶液中混有少量的NaCl,要得到KNO3 晶体的方法是_______。
(4)A是80℃含有120 g水的KNO3溶液。经过如下操作,得到102 gKNO3固体。
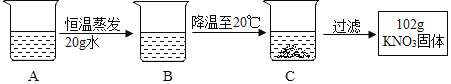
对以上过程的分析,正确的是__________(选填编号)。
① A到B的过程中,溶质质量没有改变
② B中溶质与溶剂的质量比为 169:100
③ 开始析出KNO3固体的温度在60℃至80℃之间
④ A溶液的质量等于222 g