题目内容
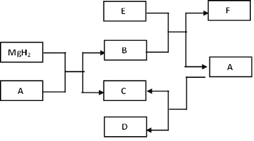
【题目】某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组利用废液制取海绵铜(Cu)和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)。请回答下列问题:

(1)操作Ⅰ和操作Ⅱ中需用到玻璃棒,其作用是_________;
(2) 产品F为________,溶液D中含有溶质为____________;
(3) 往固体B中加入过量C的过程中反应的化学方程式为:__________________;
(4) A-G七种物质中含铁元素的物质有___________(填字母序号)。
【答案】 引流 Cu NaCl、FeCl2 Fe +2 HCl === FeCl2+H2↑ ABDEG
【解析】利用含有氯化钠、氯化铜和氯化亚铁的废液制取海绵铜(Cu)和氧化铁两种产品,为了不引入杂质,A应该用铁铁哈氯化铜反应生成铜和氯化亚铁,C是过量的铁和生成的铜,加入盐酸,铁与盐酸反应生成氯化亚铁,铜不反应,过滤可得金属铜,碱氯化亚铁溶液经过多不处理,可得氧化铁。(1)过滤操中需用到玻璃棒,其作用是引流;(2) 产品F为铜,溶液D中含有溶质为氯化亚铁;(3) 往固体铜和铁混合物中加入过量盐酸的过程中反应的化学方程式为:Fe +2 HCl === FeCl2+H2↑ ;(4) A-G七种物质中含铁元素的物质有ABDEG

【题目】将5g固体M(不含结晶水的盐),分别投入到盛有10g水的烧杯中,充分溶解后,均有固体未溶解。相关数据如下表所示。
烧杯编号 | I | II | III |
未溶解固体质量(g) | 2.8 | 1 | 0.4 |

①20℃时,M溶液是____(选填“饱和”“不饱和”)溶液。
②根据下表20℃时物质的溶解度可以判断其溶解性。M属于_______溶物质。
溶解度(g/100g水) | <0.01 | 0.01-1 | 1-10 | >10 |
溶解性 | 难溶 | 微溶 | 可溶 | 易溶 |
③有关烧杯II和烧杯III中的M溶液,说法正确的是______。
A.30℃时,M的溶解度较大
B.烧杯III中溶液所含的溶质较多
C.M溶液的溶质质量分数相等
D.分别降温至20℃,溶液中析出等质量的M
④40℃时,烧杯III中再加入35g水,M溶液的溶质质量分数为______。