题目内容
【题目】常用燃烧法测定有机物的组成。现取2.3g某有机物在足量的氧气中完全燃烧 ,生成4.4gCO2和2.7gH2O。对该物质的组成有下列推断:①一定含C、H元素②一定不含O元素③可能含O元素④一定含O元素⑤分子中C、H的原子个数比为2:5⑧分子中C、H、O元素的质量比为12:3:8。其中正确的是
A. ①②⑤ B. ①④⑥ C. ①③⑥ D. ①③⑤
【答案】B
【解析】
解:由题意,反应后 CO2和 H2O生成,有机物一定含有C、H两种元素,则①正确;CO2中C元素的质量4.4g×![]() ×100%=1.2g,H2O中H元素的质量2.7g×
×100%=1.2g,H2O中H元素的质量2.7g×![]() ×100%=0.3g,1.2g+0.3g=1.5g<2.3g,说明有氧元素,则②③不正确,④正确,C、H、O元素的质量比为:1.2g:0.3g:(2.3-1.5)g=12:3:8,则⑥正确,C、H的原子个数比为:
×100%=0.3g,1.2g+0.3g=1.5g<2.3g,说明有氧元素,则②③不正确,④正确,C、H、O元素的质量比为:1.2g:0.3g:(2.3-1.5)g=12:3:8,则⑥正确,C、H的原子个数比为:![]() :
:![]() =1:3,则⑤不正确。
=1:3,则⑤不正确。
故选B。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】为研究锌和铝的金属活动性 ,某研究小组进行了如下探究。
(1)小明设计方案:向表面积相同的铝片和锌粒中分别加入盐酸,根据反应的快慢判断两者的活动性强弱。写出铝与盐酸反应的化学方程式:________。
(2)小芳将一砂纸打磨过的铝片放入一定量的盐酸中,发现有气泡产生 ,还观察到有“灰黑色沉淀”这一异常现象出现。
(提出问题)铝与盐酸反应出现的灰黑色沉淀的组成是什么?
(查阅文献)①铝在颗粒较小时为灰黑色,AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。②一种金属加入到两种活动性均比它弱的金属化合物溶液的混合液中,会先置出最弱的金属。再置换出第二种金属。该金属会先和最弱的金属盐溶液反应。
(提出合理假设)假设a:该灰黑色沉淀可能含有_________;假设b:该灰黑色沉淀可能含有AlCl3;假设c:该灰黑色沉淀可能含有难溶于酸的物质。
(设计并完成实验)取灰黑色沉淀分别进行如下实验。
实验编号 | 实验操作 | 实验现象 |
① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
② | 加入适量蒸馏水 | 固体部分溶解 |
③ | 加入适量无水乙醇 | 固体部分溶解 |
(得出结论)由实验①可判断假设c_____________(填“成立”或“不成立”,)再集合②和③可得出该灰黑色沉淀的成分是__________。
(3)你认为①中小明的实验能否比较锌和铝的金属活动性强弱?______(填“能”或“不能”),分别从设计方法或操作可行性的角度,具体说明理由(一点即可)_____。
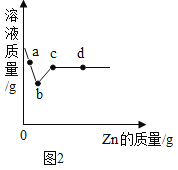
(拓展延伸)附加分:若正确回答下列小题,将获得4分的奖励 ,但化学试卷总分不超过60分。为继续研究另一种金属锌的化学性质,小敏向一定质量的硝酸银和硝酸铜的混合溶液中加入锌粉,溶液质量与加入锌的质量关系如图所示。那么,在a点时,溶液里含的金属化合物有_________种;bc段发生的化学反应方程式为_________;d点得到的固体的成分为_____
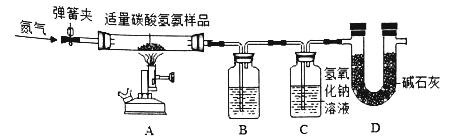
【题目】今年我省人大和政协两会使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与酸反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | 2.64 | 3.52 | 3.52 |
(1)10g样品与足量稀盐酸反应最多生成_____g气体;
(2)上述实验中盐酸过量的是烧杯_____(填序号);
(3)求样品中碳酸钙的质量分数_____。(写出计算过程)