题目内容
今有A、B、C、D、E五种装置如下图所示.按要求回答问题(所选装置用字母回答)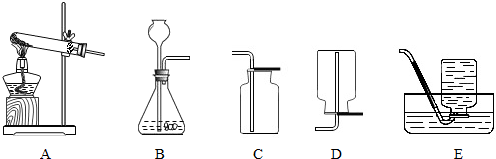
(1)实验室用氯酸钾和二氧化锰的混合物制取氧气时,应选用的发生装置是
(2)实验室用大理石和稀盐酸反应来制取二氧化碳,应选用的发生装置是
(3)某同学准备用加热高锰酸钾的方法制取0.8g的氧气.则计算
①高锰酸钾(KMnO4)的相对分子质量为
②反应的化学方程式:
③要制取0.8g的氧气,需要高锰酸钾的质量为
分析:(1)和(2)都是根据反应物状态来选择发生装置,根据气体的密度和溶解性来选择收集装置;(3)要制取0.8g的氧气,需要高锰酸钾的质量根据方程式计算.
解答:解:(1)用氯酸钾和二氧化锰的混合物制取氧气时,需要加热选择A装置,氧气不易溶于水可以用排水法收集,密度比空气大,可以用向上排空气法收集;
(2)实验室用大理石和稀盐酸反应来制取氢气时,不需要加热选择B装置,二氧化碳能溶于水密度比空气大,只能用向上排空气法收集;
(3)要制取0.8g的氧气,设需要高锰酸钾的质量为X:
2KMnO4
K2MnO4+MnO2+O2↑
316 32
X 0.8g
列比例式:
=
,解得X=7.9g
故答案为:
(1)A;C或E;2KClO3
2KCl+3O2↑.
(2)B;C;CaCO3+2HCl=CaCl2+CO2↑+H2O
(3)①158;
②2KMnO4
K2MnO4+MnO2+O2↑
③7.9g
(2)实验室用大理石和稀盐酸反应来制取氢气时,不需要加热选择B装置,二氧化碳能溶于水密度比空气大,只能用向上排空气法收集;
(3)要制取0.8g的氧气,设需要高锰酸钾的质量为X:
2KMnO4
| ||
316 32
X 0.8g
列比例式:
| 316 |
| 32 |
| X |
| 0.8g |
故答案为:
(1)A;C或E;2KClO3
|
(2)B;C;CaCO3+2HCl=CaCl2+CO2↑+H2O
(3)①158;
②2KMnO4
| ||
③7.9g
点评:发生装置的选择要看反应物的状态,固体与固体制取气体需加热,固体与液体制取气体不需要加热;收集装置的选择要看该气体的密度和溶解性,密度比空气大,用向上排空气法收集,密度比空气小,用向下排空气法收集,不易溶于水或难溶于水用排水法收集.

练习册系列答案
相关题目