题目内容
42、现有甲、乙、丙三种可溶性的正盐溶液,按下图所示进行实验,且甲与乙、乙与丙均恰好完全反应.
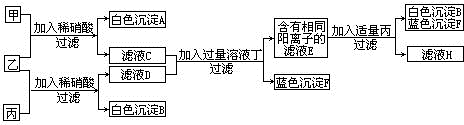
试推断:(写出化学式或离子符号)
溶液甲是

试推断:(写出化学式或离子符号)
溶液甲是
AgNO3
,沉淀B是BaSO4
,溶液乙是BaCl2
,沉淀F是Cu(OH)2
,滤液E中的溶质是Ba(NO3)2、Ba(OH)2、BaCl2
,滤液H中一定含有的阴离子是NO3-、Cl-
.分析:不溶于稀硝酸的沉淀只有硫酸钡和氯化银,故可以判断乙为氯化钡溶液,而白色沉淀A和B为氯化银和硫酸钡,加入过量的丁溶液生成了蓝色沉淀可以知道F为氢氧化铜,所以在滤液C和D中含有铜离子,故可以判断甲和丙分别为硝酸银溶液和硫酸铜溶液,不妨设甲为硝酸银而丙为硫酸铜,那么滤液C为硝酸钡,而滤液D为氯化铜,而加入过量的丁之后的得到含有相同的阳离子,所以可以判断溶液丁为氢氧化钡溶液,所以可以知道滤液E中含有的钡离子,那么生成的白色沉淀B为硫酸钡,所以可以判断丙为硫酸铜,与我们刚才的假设相同,至此各物质鉴定完毕,带入验证符合题意,可以据此答题.
解答:解:甲乙丙三种物质相互反应生成了不溶于稀硝酸的沉淀,而不溶于稀硝酸的沉淀只有硫酸钡和氯化银,故可以判断乙为氯化钡,而白色色沉淀A和B为氯化银和硫酸钡,加入过量的丁溶液生成了蓝色沉淀可以知道F为氢氧化铜,所以在滤液C和D中含有铜离子,故可以判断甲和丙分别为硝酸银溶液和硫酸铜溶液,不妨设甲为硝酸银而丙为硫酸铜,那么滤液C为硝酸钡,而滤液D为氯化铜,而加入过量的丁之后的得到含有相同的阳离子,所以可以判断溶液丁为氢氧化钡溶液,所以可以知道滤液E中含有钡离子,那么生成的白色沉淀B为硫酸钡,所以可以判断丙为硫酸铜,与我们刚才的假设相同,根据分析可以知道硫酸根离子以沉淀的形式析出,那么H中肯定含有的阴离子为硝酸根离子和氯离子.
故答案为:AgNO3;BaSO4;BaCl2;Cu(OH)2;Ba(NO3)2、Ba(OH)2、BaCl2;NO3-、Cl-.
故答案为:AgNO3;BaSO4;BaCl2;Cu(OH)2;Ba(NO3)2、Ba(OH)2、BaCl2;NO3-、Cl-.
点评:熟练掌握常见物质的化学性质,能够根据所给的图示关系判断反应是否能够发生,进而得出正确的答案,知道我们所接触到的不溶于稀硝酸的白色沉淀只有氯化银和硫酸钡.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 如图是甲、乙、丙三种物质的溶解度曲线.现有甲、乙、丙三种物质的饱和溶液(无固体存在),请根据如图回答:
如图是甲、乙、丙三种物质的溶解度曲线.现有甲、乙、丙三种物质的饱和溶液(无固体存在),请根据如图回答: 如图是甲、乙、丙三种物质的溶解度曲线.现有甲、乙、丙三种物质的饱和溶液(无固体存在),请根据如图回答:
如图是甲、乙、丙三种物质的溶解度曲线.现有甲、乙、丙三种物质的饱和溶液(无固体存在),请根据如图回答: