题目内容
MgSO4·7H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3)为原料制备MgSO4·7H2O的主要流程如下:
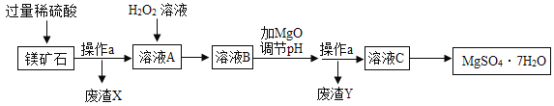
已知:SiO2既不溶于水也不溶于稀硫酸。请回答下列问题:
(1)“操作a”的名称是______。
(2)“废渣Y”中含有少量的FeOOH,其中铁元素的化合价是______。
(3)MgCO3溶于稀硫酸的化学方程式为______。
(4)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为______。
(5)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是______。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
试求:
(1)m的值为 64 g(1分)
(2)12g石灰石样品中碳酸钙的质量等于 65 g(2分)
(3)反应完全后最终溶液中氯化钙的质量分数? 66 (3分)
(写出计算过程,计算结果精确至0.1)
通过下列实验操作和现象能得出正确结论的是
实验操作 | 现象 | 结论 | |
A | 向 H2O2 溶液中加入少量 MnO2 粉末 | 产生大量气体 | MnO2 是该反应的催化剂 |
B | 50℃时, 将 17g KCI 固体加入50g蒸馏水中,完全溶解后缓慢降温 | 降温至20℃时开始有晶体析出 | 20℃ 时, KCl 的溶解度为 17g |
C | 往久置于空气中的氢氧化钠溶液滴加稀硫酸 | 有气泡 | 氢氧化钠溶液已变质 |
D | 在某无色溶液中滴加氯化钡溶液 | 有白色沉淀 | 无色溶液中一定含有SO42- |
A. A B. B C. C D. D