题目内容
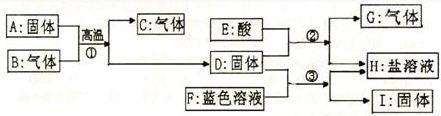
已知:A是红色粉末,B、C是氧化物,D、I是常见金属,E为胃酸的主要成分,G为单质.它们之间的转化关系如下:

请分析并完成:
(1)反应①中被还原的物质的化学式
(2)写出③的化学反应方程式
(3)②反应前后,溶液的质量
A.不变 B.增大 C.减小.

请分析并完成:
(1)反应①中被还原的物质的化学式
Fe2O3
Fe2O3
;(2)写出③的化学反应方程式
CuCl2+Fe═Cu+FeCl2
CuCl2+Fe═Cu+FeCl2
;(3)②反应前后,溶液的质量
B
B
(填序号)A.不变 B.增大 C.减小.
分析:根据E为胃酸的主要成分,可以知道E为盐酸,而D可以和盐酸反应生成气体和浅绿色溶液,可以知道气体G为氢气,而浅绿色溶液H为氯化亚铁溶液,那么D为铁,进而可以判断出红色粉末A为氧化铁,那么气体B为一氧化碳,而气体C为二氧化碳,固体D可以和蓝色溶液F反应生成氯化亚铁溶液,所以可以判断F为氯化铜溶液,而固体I为铜,至此各物质鉴定完毕,带入验证符合题意,可以据此答题.
解答:解:(1)根据E为胃酸的主要成分,可以知道E为盐酸,而D可以和盐酸反应生成气体和浅绿色溶液,可以知道气体G为氢气,而浅绿色溶液H为氯化亚铁溶液,那么D为铁,进而可以判断出红色粉末A为氧化铁,那么气体B为一氧化碳,而气体C为二氧化碳,固体D可以和蓝色溶液F反应生成氯化亚铁溶液,所以可以判断F为氯化铜溶液,而固体I为铜;
所以反应①为氧化铁和一氧化碳的反应,根据氧化还原反应的实质可以知道被还原的物质为氧化铁,其化学式为:Fe2O3;
(2)根据(1)中的解答可以知道反应③为铁和氯化铜溶液的反应,该反应生成了铜和氯化亚铁,其反应的化学方程式为:CuCl2+Fe═Cu+FeCl2;
(3)根据(1)的解答可以知道反应②为铁和盐酸的反应,根据它们反应的化学方程式可以知道消耗的铁和生成氢气的质量关系为:Fe+2HCl═FeCl2+H2↑
56 2
即每消耗56g铁能够生成氢气的质量为2g,所以反应前后溶液的质量要增加,故选B.
故答案为:(1)Fe2O3;
(2)CuCl2+Fe═Cu+FeCl2;
(3)B.
所以反应①为氧化铁和一氧化碳的反应,根据氧化还原反应的实质可以知道被还原的物质为氧化铁,其化学式为:Fe2O3;
(2)根据(1)中的解答可以知道反应③为铁和氯化铜溶液的反应,该反应生成了铜和氯化亚铁,其反应的化学方程式为:CuCl2+Fe═Cu+FeCl2;
(3)根据(1)的解答可以知道反应②为铁和盐酸的反应,根据它们反应的化学方程式可以知道消耗的铁和生成氢气的质量关系为:Fe+2HCl═FeCl2+H2↑
56 2
即每消耗56g铁能够生成氢气的质量为2g,所以反应前后溶液的质量要增加,故选B.
故答案为:(1)Fe2O3;
(2)CuCl2+Fe═Cu+FeCl2;
(3)B.
点评:本题为框图式物质推断题,完成此题,可以依据题干提供的信息,找准解题突破口,直接得出有关物质的化学式,然后顺推或逆推得出其他物质的化学式,进而完成解答即可.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目

 请回答:
请回答: