题目内容
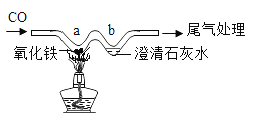
【题目】已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2。现利用下图1的实验装置进行实验,反应过程中管内的固体质量随温度的变化曲线如图2。
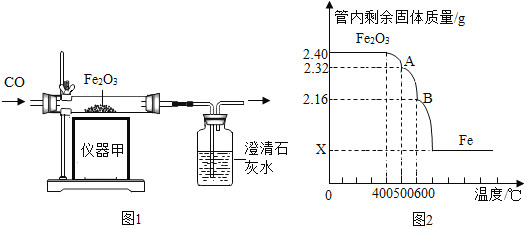
注:图1中的仪器甲是一种加热仪器,图2中A、B点的固体组成分别是FeO、Fe3O4中的一种。
(1)查阅资料发现,酒精灯加热时玻璃管的受热温度是400~500℃,酒精喷灯加热时玻璃管的受热温度是800~1200℃。实验室要利用图1来制取金属铁,仪器甲应选用的加热仪器是_____(填“酒精灯”或“酒精喷灯”);图1装置中的现象有____;________。
(2)利用图2显示的相关信息,回答如下问题:
①在0~400℃温度范围内,管内固体质量不变,其原因是________。
②图中x=__g。
计算过程:_____
③试据图计算并推断出A点固体的化学式是______。
【答案】酒精喷灯 玻璃管内红棕色粉末逐渐变为黑色 澄清石灰水变浑浊 没有达到反应所需的温度 1.68g 解:设完全反应生成铁的质量为x.
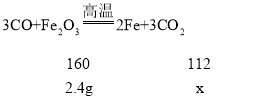
![]()
解得x=1.68g
答:完全反应生成的铁质量为1.68g。 Fe3O4
【解析】
(1)根据资料信息,酒精灯加热时玻璃管的受热温度是400~500℃,酒精喷灯加热时玻璃管的受热温度是800~1200℃。实验室要利用图1来制取金属铁,反应条件是高温,因此仪器甲应选用的加热仪器是:酒精喷灯;因为一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,氧化铁是红棕色,铁粉是黑色,二氧化碳能使澄清石灰水变浑浊,所以图1装置中的现象有:玻璃管内红棕色粉末逐渐变为黑色;澄清石灰水变浑浊。
(2)①因为一氧化碳和氧化铁反应必须达到一定的温度,在0~400℃温度范围内,管内固体质量不变,其原因是:没有达到反应所需的温度。
②图中x是氧化铁完全反应转变成铁的质量。设完全反应生成铁的质量为x.
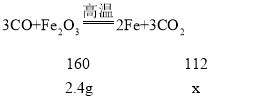
![]()
解得x=1.68g
答:完全反应生成的铁质量为1.68g。
③图中A点固体与氧化铁的质量差就是减少的氧元素质量,根据化学式Fe2O3,2.4g氧化铁中,铁元素质量=![]() =1.68g,氧元素的质量=2.4g-1.68g=0.72g。到A点固体质量为2.32g,则A点固体中铁元素的质量仍为1.68g,氧元素的质量=0.72g-(2.40g-2.32g)=0.64g,假设A点固体中物质的化学式是FemOn,
=1.68g,氧元素的质量=2.4g-1.68g=0.72g。到A点固体质量为2.32g,则A点固体中铁元素的质量仍为1.68g,氧元素的质量=0.72g-(2.40g-2.32g)=0.64g,假设A点固体中物质的化学式是FemOn,![]()
![]() 则A点固体中物质的化学式是Fe3O4。
则A点固体中物质的化学式是Fe3O4。

 阅读快车系列答案
阅读快车系列答案【题目】碳酸钠在实际生产、生活中有着广泛的用途,如制造玻璃、造纸和纺织等。
(1)碳酸钠俗称苏打或____。如图为侯氏制碱法的流程图,通过步骤I后得到的悬浊液中有小苏打(在该溶液中难溶)和一种氮肥,请写出步骤I中发生反应的化学方程式:_____;上述过程中得到的氮肥遇碱会生成具有刺激性气味的______(填化学式),该气体能使_____;从流程图中可得出小苏打的一条化学性质是_____。
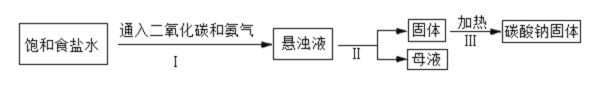
(2)氢氧化钠在空气中容易变质生成碳酸钠,现有放在空气中一段时间的氢氧化钠溶液,其中溶质的成分可能是:猜想①:NaOH;猜想②:Na2CO3;猜想③:_____。请设计实验证明猜想③正确。(写出相关的步骤和现象)________
(3)某海洋化工集团生产的碳酸钠产品中含有少量氯化钠杂质,其产品包装袋上标明:碳酸钠≥96%。为测定该产品中碳酸钠的质量分数,现取11.0g碳酸钠样品放入烧杯中,称得烧杯及所盛碳酸钠样品的总质量为158.0g,然后向烧杯中加入100g稀盐酸,充分反应,实验数据记录如下:
反应时间/min | 3 | 6 | 9 | 12 |
烧杯及所盛物质的总质量/g | 255.8 | 254.0 | 253.6 | 253.6 |
请你据此分析计算,该产品中碳酸钠的质量分数_____(是、否)符合标准。(写出计算过程,结果精确到0.1%)