题目内容
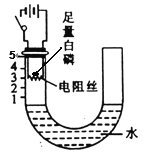
【题目】利用图甲装置探究“MnO2的用量对 H2O2分解反应的影响”,实验中H2O2的溶质质量分数为3%,装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比。反应放热忽略不计)

(1)写出装置中发生反应的文字或符号表达式: ,MnO2在此反应前后 和 不发生改变。
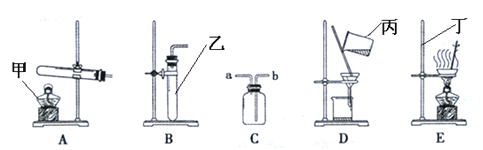
(2)图乙是“0.1克MnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出 。
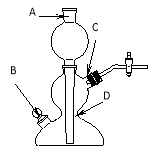
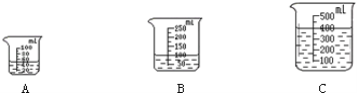
(3)当用“3%H2O2溶液8毫升与不同质量的MnO2混合”时,得到如图丙所示的曲线。曲线的斜率显示,当MnO2的用量增加到0.08克时,分解速度达到实验要求。在此实验条件下,若MnO2的质量有4克(一药匙),就能使如图 (选填字母)烧杯中所装的3%H2O2溶液,其分解速度最接近实验要求。
【答案】(1)过氧化氢![]() 水+氧气;质量;化学性质
水+氧气;质量;化学性质
(2)其他条件相同时,H2O2的用量越多,产生的氧气越多
(3)C
【解析】
试题分析∶与题中信息知,(1)装置中发生反应的文字或符号表达式:过氧化氢![]() 水+氧气。MnO2在此反应前后质量和化学性质不发生改变。(2)图乙是“0.1克MnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出其他条件相同时,H2O2的用量越多,产生的氧气越多。(3)当用“3%H2O2溶液8毫升与不同质量的MnO2混合”时,得到如图丙所示的曲线。曲线的斜率显示,当MnO2的用量增加到0.08克时,分解速度达到实验要求。在此实验条件下,若MnO2的质量有4克(一药匙),就能使如图C.烧杯中所装的3%H2O2 溶液,其分解速度最接近实验要求。
水+氧气。MnO2在此反应前后质量和化学性质不发生改变。(2)图乙是“0.1克MnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出其他条件相同时,H2O2的用量越多,产生的氧气越多。(3)当用“3%H2O2溶液8毫升与不同质量的MnO2混合”时,得到如图丙所示的曲线。曲线的斜率显示,当MnO2的用量增加到0.08克时,分解速度达到实验要求。在此实验条件下,若MnO2的质量有4克(一药匙),就能使如图C.烧杯中所装的3%H2O2 溶液,其分解速度最接近实验要求。
考点∶考查探究“MnO2的用量对 H2O2分解反应的影响”。

【题目】一定条件下,在密闭容器中发生某反应,测得反应过程中的部分数据如下表所示。下列关于表中未知数据①~④的结论正确的是
物质 | M | N | P | Q |
反应前的质量/g | 10 | 10 | 0 | 0 |
反应中的质量/g | 6 | 2 | 3 | ① |
反应后的质量/g | ② | 0 | ③ | ④ |
A. ①为7 B. ②为4 C. ③为3.25 D. ④为11.25