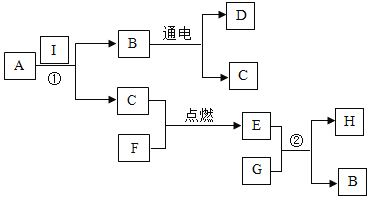
题目内容
【题目】结合所学化学知识,回答下列问题:
(1)厨房中的下列物品所使用的主要材料属于金属材料的是______;
A、陶瓷碗 B、不锈钢炊具 C、橡胶手套 D、铜质水龙头
(2)生铁和钢都是铁的合金,二者性能不同的原因是_______;
(3) 波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁质容器配制波尔多液的原因是_______(用化学方程式表示)
(4)金属生锈是世界面临的难题。铁生锈实际上是铁与____共同作用的结果。
(5)防止金属腐蚀是保护金属资源的有效途径之一。请再写出一条有效途径:___________。
(6)铝具有良好的抗腐蚀性能,原因是______(写出化学方程式)
(7)动车电路中导线大多是用铜制的,这是利用了铜的延展性和______。动车使用的金属材料大多是合金而不是纯金属,这是因为合金具有更多优良性能,例如,钢比纯铁硬度______(填“大”或“小”);
(8)请你从化学的角度写出一种自行车出行的好处_______。
(9)地球上的铁元素以(“单质”或“化合物”)___的形式存在。可用于炼铁的一种矿石是 ______ 。
(10)用生铁制防盗门而不用纯铁的主要原因是 ________ 。在防盗门表面喷漆,其防锈原理是 __________ ,喷漆前用稀盐酸除铁锈的化学方程式为 ___________ 。
(11)铝热剂是修建铁路时常用的焊接材料,其反应原理是在高温下,铝与氧化铁反应得到熔融的铁与一种氧化物。该反应的化学方程式为______。
(12)新型食品保鲜剂“纳米α铁粉”被称为“双吸剂”,其实质就是利用了铁生锈的原理:用化学方法检验使用一段时间的“纳米α铁粉”是否完全失效,可选用___检验,若出现_____现象,说明该双吸剂仍可使用.
(13)已知M、N、R三种金属存在如下反应:R+NCl2=N+RCl2;M+RCl2=R+MCl2,这两个反应的基本反应类型都是________,M、N、R三种金属的活动性由强到弱的顺序为_________。
(14)为了探究锰、锌、铁三种金属活动性顺序,某同学设计将锰块、锌粒和铁块分别放入质量和质量分数均相同的稀盐酸中进行实验,该同学实验设计中的不足之处是________.
(15)向铁粉和氧化铜粉末的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,得滤渣和滤液。向滤液中加一洁净铁片,未看到铁片有任何变化。则滤液中含有的溶质是______(填化学式),滤渣中一定含有的物质是______(填化学式)。
【答案】BD含碳量不同Fe+CuSO4=Cu+FeSO4氧气、水对金属材料进行回收利用4Al+3O2=2Al2O3导电性大减少对空气的污染化合物赤铁矿生铁硬度大隔绝空气中的氧气Fe2O3+6HCl=2FeCl3+3H2O2Al+Fe2O3 ![]() 2Fe+Al2O3稀盐酸有气泡生成置换反应M>R>N金属的形状不同,可能会对实验结论造成影响FeSO4Cu
2Fe+Al2O3稀盐酸有气泡生成置换反应M>R>N金属的形状不同,可能会对实验结论造成影响FeSO4Cu
【解析】
(1)A、陶瓷碗属于无机非金属材料,选项错误;B、不锈钢属于合金,属于金属材料,选项正确;C、橡胶手套属于有机材料,选项错误;D、铜属于金属,属于金属材料,选项正确。故本题选BD;
(2)生铁和钢都是铁的合金,二者性能不同的原因是含碳量不同;
(3)波尔多液中含有硫酸铜,铁能和硫酸铜溶液反应生成铜和硫酸亚铁,故不能用铁制品盛放波尔多液,反应的化学方程式为Fe+CuSO4=Cu+FeSO4;
(4)铁生锈实际上是铁与氧气、水共同作用的结果;
(5)防止金属腐蚀是保护金属资源的有效途径之一,对金属材料进行回收利用也是保护金属资源的有效途径;
(6)铝具有良好的抗腐蚀性能,原因是铝能和空气中的氧气反应生成一层致密的氧化铝薄膜,阻止氧气进一步氧化,反应的化学方程式为4Al+3O2=2Al2O3;
(7)动车电路中导线大多是用铜制的,这是利用了铜的延展性和导电性;合金比纯金属具有更多优良性能,钢比纯铁硬度大;
(8)自行车出行从化学角度来讲,属于低碳出行,减少对空气的污染;
(9)铁的化学性质较为活泼,故地球上的铁元素以化合物的形式存在;可用于炼铁的一种矿石是赤铁矿;
(10)用生铁制防盗门而不用纯铁的主要原因是生铁硬度大;在防盗门表面喷漆,其防锈原理是隔绝空气中的氧气;铁锈的主要成分是氧化铁,稀盐酸能和氧化铁反应生成氯化铁和水,反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O;
(11)在高温下,铝与氧化铁反应得到熔融的铁与一种氧化物,根据质量守恒定律可知,该氧化物为氧化铝,故反应的化学方程式为2Al+Fe2O3 ![]() 2Fe+Al2O3;
2Fe+Al2O3;
(12)铁能和稀盐酸反应生成氯化亚铁和氢气,故检验使用一段时间的“纳米α铁粉”是否完全失效,可选用稀盐酸检验;若出现有气泡生成现象,说明该双吸剂仍可使用;
(13)这两个反应均符合一种单质和一种化合物反应生成另一种单质和另一种化合物的特征,故均为置换反应;R能置换N,说明R比N活泼,M能置换R,说明M比R活泼,故三种金属活动性顺序为M>R>N;
(14)该同学实验设计中的不足之处是金属的形状不同,可能会对实验结论造成影响;
(15)向滤液中加一洁净铁片,未看到铁片有任何变化,说明滤液中没有铜离子,故溶质为硫酸亚铁,化学式为FeSO4;加入稀硫酸后,稀硫酸先和氧化铜反应,后铁将铜置换出来,因未说明铁粉用量,故滤渣中一定含有铜,化学式为Cu;

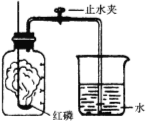
【题目】某化学兴趣小组的同学按照课本上的实验装置做“测定空气中氧气的体积分数”实验(如图所示),但测出的氧气的体积分数明显小于1/5。请你参与探究:

(提出问题)造成误差的原因是什么?如何改进课本上的实验装置?
(查阅资料)红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度/(g/cm3) | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(猜想与假设)
甲同学:可能是导管内原含有空气,后来留有吸入的水,影响实验的准确性。
乙同学:可能是瓶内残留气体中还有氧气。
你还能作出的猜想是_____ ;___________(两个)。
(交流与讨论)
(1)丙同学认为用木炭代替红磷,他的猜想不合理,理由是______
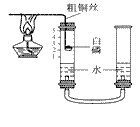
(2)他们对课本上的实验装置进行了右图所示的改进(其他仪器忽略)。
①甲同学提出应把红磷换为白磷,则白磷燃烧文字表达式________。
②与课本上的实验装置相比较,该装置的两个优点是________;___。