题目内容
【题目】某化学兴趣小组的同学对有关氧气方面进行探究
探究一:对空气中氧气含量的测定实验进行探究:
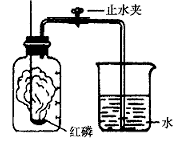
(1)如图甲所示装置和药品进行实验,集气瓶中发生反应的文字或符号表达式为 , 实验中可观察到红磷燃烧的现象是。
(2)该组同学做了6次实验,整理数据如下:
1 | 2 | 3 | 4 | 5 | 6 | |
进入集气瓶中水的体积(mL) | 20 | 21 | 19 | 20 | 22 | 18 |
(注:集气瓶容积为100mL)通过6次实验,该组同学探究出氧气约占空气体积的 ,
(3)小林同学利用甲图装置测定空气中氧气的含量,下列操作会使测定结果偏小的是
A.实验装置可能漏气
B.实验中所取的红磷过量
C.实验前没有将弹簧夹夹紧
D.红磷燃烧结束后,没等装置冷却就打开弹簧夹
(4)小组内同学查阅资料后知道白磷40℃即燃烧,燃烧产物与红磷相同,于是采用改进后的乙装置进行重新探究.主要操作是:在实际容积为100mL的集气瓶里先装进30mL的水,再按图连好仪器,按下热的玻璃棒,白磷立即被点燃.
①白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是 , 若实验非常成功,最终集气瓶中水的体积约为mL.
②你认为集气瓶里预先装进的水有哪些作用?(填序号)
a.加快集气瓶冷却 b.液封导气管末端以防气体逸出 c.缓冲集气瓶内气压的骤然升高
(5)探究二:对有关制取氧气时催化剂进行探究:
实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气.小静发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂.
【完成实验】按下表进行实验,并测定分解温度(分解温度越低,说明催化效果越好).
实验编号 | 实验药品 | 分解温度(℃) |
① | KClO3 | 580 |
② | KClO3、MnO2(质量比1:1) | 350 |
③ | KClO3、CuO (质量比l:1) | 370 |
④ | KClO3、Fe2O3(质量比1:1) | 390 |
【分析数据、得出结论】
由实验与实验④对比,证明猜想可能合理。写出加热氯酸钾和二氧化锰混合反应文字或符号表达式。
(6)实验所用的三种金属氧化物,催化效果最好的是 .
(7)【反思】若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后的质量和不变;
(8)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证。
【答案】
(1)红磷+氧气 ![]() 五氧化二磷或4P+5O2
五氧化二磷或4P+5O2 ![]() 2P2O5,产生大量的白烟
2P2O5,产生大量的白烟
(2)![]() 或20%
或20%
(3)A,D
(4)先下降后上升,44,abc
(5)①,氯酸钾 ![]() 氯化钾+氧气
氯化钾+氧气
(6)MnO2
(7)化学性质
(8)将氯酸钾与不同颗粒大小的同种催化剂等比充分混合,加热测定分解温度
【解析】解:(1)如图甲所示装置和药品进行实验,集气瓶中发生反应的文字或符号表达式为红磷+氧气 ![]() 五氧化二磷或4P+5O2
五氧化二磷或4P+5O2 ![]() 2P2O5;实验中可观察到红磷燃烧的现象是产生大量的白烟;(2)通过6次实验,该组同学探究出氧气约占空气体积的1/5或20%;(3)小林同学利用甲图装置测定空气中氧气的含量,下列操作会使测定结果偏小的是A、实验装置可能漏气可能造成测定结果偏小;B、实验中所取的红磷过量测定结果正常;C、实验前没有将弹簧夹夹紧,会造成实验结果偏大;D、红磷燃烧结束后,没等装置冷却就打开弹簧夹,会造成实验结果偏小;故答案选择AD;(4)①白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是先下降后上升,因为燃烧放热气压增大集气瓶中的水先减小,冷却到室温由于消耗气体瓶中气压小于大气压故烧杯中的水进入集气瓶中;若实验非常成功,最终集气瓶中水的体积约为30 mL +70 mL ×1/5=44 mL,②集气瓶里预先装进的水有a.加快集气瓶冷却 b.液封导气管末端以防气体逸出 c.缓冲集气瓶内气压的骤然升高;(5)由实验①与实验④对比,证明猜想可能合理。加热氯酸钾和二氧化锰混合反应文字或符号表达式:氯酸钾
2P2O5;实验中可观察到红磷燃烧的现象是产生大量的白烟;(2)通过6次实验,该组同学探究出氧气约占空气体积的1/5或20%;(3)小林同学利用甲图装置测定空气中氧气的含量,下列操作会使测定结果偏小的是A、实验装置可能漏气可能造成测定结果偏小;B、实验中所取的红磷过量测定结果正常;C、实验前没有将弹簧夹夹紧,会造成实验结果偏大;D、红磷燃烧结束后,没等装置冷却就打开弹簧夹,会造成实验结果偏小;故答案选择AD;(4)①白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是先下降后上升,因为燃烧放热气压增大集气瓶中的水先减小,冷却到室温由于消耗气体瓶中气压小于大气压故烧杯中的水进入集气瓶中;若实验非常成功,最终集气瓶中水的体积约为30 mL +70 mL ×1/5=44 mL,②集气瓶里预先装进的水有a.加快集气瓶冷却 b.液封导气管末端以防气体逸出 c.缓冲集气瓶内气压的骤然升高;(5)由实验①与实验④对比,证明猜想可能合理。加热氯酸钾和二氧化锰混合反应文字或符号表达式:氯酸钾 ![]() 氯化钾+氧气;(6)实验所用的三种金属氧化物,催化效果最好的是二氧化锰,因为分解温度最低;(7)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后的质量和化学性质不变;(8)同种催化剂,颗粒大小可能影响催化效果可设计成将氯酸钾与不同颗粒大小的同种催化剂等比充分混合,加热测定分解温度进行试验。
氯化钾+氧气;(6)实验所用的三种金属氧化物,催化效果最好的是二氧化锰,因为分解温度最低;(7)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后的质量和化学性质不变;(8)同种催化剂,颗粒大小可能影响催化效果可设计成将氯酸钾与不同颗粒大小的同种催化剂等比充分混合,加热测定分解温度进行试验。
所以答案是:(1)红磷+氧气 ![]() 五氧化二磷或4P+5O2
五氧化二磷或4P+5O2 ![]() 2P2O5;产生大量的白烟;(2)1/5或20%;(3)AD;(4)先下降后上升;44 mL;abc;(5)①;氯酸钾
2P2O5;产生大量的白烟;(2)1/5或20%;(3)AD;(4)先下降后上升;44 mL;abc;(5)①;氯酸钾 ![]() 氯化钾+氧气;(6)MnO2;(7)化学性质;(8)将氯酸钾与不同颗粒大小的同种催化剂等比充分混合,加热测定分解温度。
氯化钾+氧气;(6)MnO2;(7)化学性质;(8)将氯酸钾与不同颗粒大小的同种催化剂等比充分混合,加热测定分解温度。