题目内容
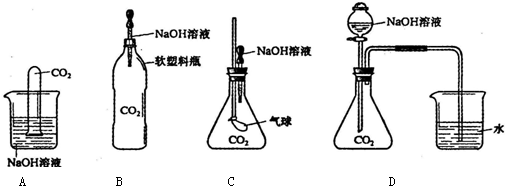
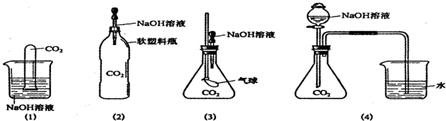
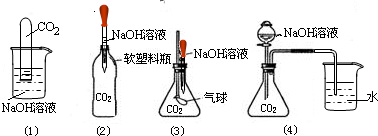
 某实验小组的同学设计了一个实验来验证质量守恒定律,所用仪器和药品如图所示:
某实验小组的同学设计了一个实验来验证质量守恒定律,所用仪器和药品如图所示:反应前,在天平上称量整套装置,总质量为mg.按下列步骤进行实验,请回答相关问题:
(1)将胶头滴管中的盐酸逐渐滴入盛有大理石的试管中,立即有气泡在试管中产生,有关反应的化学方程式为
2HCl+CaCO3=CaCl2+H2O+CO2↑
2HCl+CaCO3=CaCl2+H2O+CO2↑
;片刻后在锥形瓶中看到的现象是
石灰水变浑浊
石灰水变浑浊
,有关反应的化学方程式为
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
.待反应停止,再将整套装置放到天平上称量(包括残留物)质量仍为mg.由此可以得到的结论
在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和
在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和
.(2)该实验若改在烧杯中进行,不能验证质量守恒定律的原因是什么?
反应生成的气体逸出,生成物的质量就会减少
反应生成的气体逸出,生成物的质量就会减少
.分析:(1)①大理石的主要成分是碳酸钙,盐酸与碳酸钙发生复分解反应,据此写出化学方程式;
②根据盐酸与碳酸钙反应的生成物与石灰水反应的现象分析,并据此写出化学方程式;
③根据已知条件“待反应停止,再将整套装置放到天平上称量(包括残留物)质量仍为mg”进行总结;
(2)如果实验不是在密闭容器中进行,生成的气体会逸出.据此分析.
②根据盐酸与碳酸钙反应的生成物与石灰水反应的现象分析,并据此写出化学方程式;
③根据已知条件“待反应停止,再将整套装置放到天平上称量(包括残留物)质量仍为mg”进行总结;
(2)如果实验不是在密闭容器中进行,生成的气体会逸出.据此分析.
解答:解:(1)①大理石的主要成分是碳酸钙,盐酸与碳酸钙反应的化学方程式为:2HCl+CaCO3=CaCl2+H2O+CO2↑;
②因为锥形瓶中是石灰水,石灰水的主要成分是氢氧化钙,盐酸与碳酸钙反应生成的二氧化碳与氢氧化钙反应生成碳酸钙沉淀,使石灰水变浑浊;有关的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
③由已知条件可知,反应停止后,整套装置质量未变,仍为mg,说明在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.
(2)该实验若改在烧杯中进行,反应生成的气体会逸出,生成物的质量就会减小,称量反应后物质的质量与反应前物质的质量就不相等.
故答案为:(1)2HCl+CaCO3=CaCl2+H2O+CO2↑;石灰水变浑浊;CO2+Ca(OH)2=CaCO3↓+H2O;在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;(2)反应生成的气体逸出,生成物的质量就会减少.
②因为锥形瓶中是石灰水,石灰水的主要成分是氢氧化钙,盐酸与碳酸钙反应生成的二氧化碳与氢氧化钙反应生成碳酸钙沉淀,使石灰水变浑浊;有关的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
③由已知条件可知,反应停止后,整套装置质量未变,仍为mg,说明在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.
(2)该实验若改在烧杯中进行,反应生成的气体会逸出,生成物的质量就会减小,称量反应后物质的质量与反应前物质的质量就不相等.
故答案为:(1)2HCl+CaCO3=CaCl2+H2O+CO2↑;石灰水变浑浊;CO2+Ca(OH)2=CaCO3↓+H2O;在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;(2)反应生成的气体逸出,生成物的质量就会减少.
点评:此题主要是考查学生的综合分析能力和总结能力.不但要求学生具备有关化合物的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,进行分析和推断.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
 随着经济的发展,能源和环境日益成为人们关注的焦点.
随着经济的发展,能源和环境日益成为人们关注的焦点.