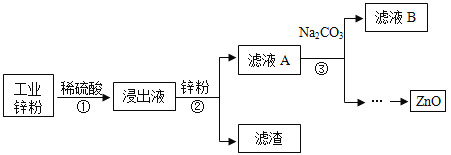
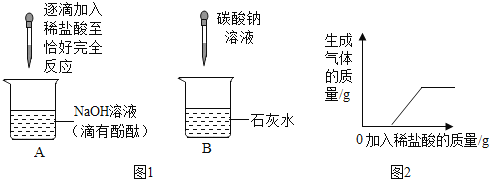
题目内容
【题目】要除去下列各组物质中的杂质(括号内的物质为杂质),所列选项中的试剂正确的是
A.![]() :稀盐酸B.
:稀盐酸B.![]() :稀盐酸
:稀盐酸
C.![]() 溶液
溶液![]() :铁粉D.
:铁粉D.![]() 气体
气体![]() :氢氧化钠溶液
:氢氧化钠溶液
【答案】B
【解析】
A、Zn能与稀盐酸反应生成氯化锌溶液和氢气,铜不与稀盐酸反应,反而会把原物质除去,不符合除杂原则,故选项所选用的试剂错误。
B、Na2CO3能与稀盐酸反应生成氯化钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所选用的试剂正确。
C、H2SO4能与铁粉反应生成硫酸亚铁溶液和氢气,能除去杂质但引入了新的杂质硫酸亚铁,不符合除杂原则,故选项所选用的试剂错误。
D、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所选用的试剂错误。
故选:B。

【题目】金属镁可与热水反应生成氢氧化镁和氢气: ![]() 所得溶液呈碱性,可使酚酞溶液显红色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
所得溶液呈碱性,可使酚酞溶液显红色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
[查阅资料]溶液红色褪去的原因是溶液碱性减弱。
[提出问题]导致溶液碱性减弱的原因是什么?
[假设与分析]
假设1:可能是氢氧化镁与N2或O2发生了反应。
假设2:可能是溶液吸收了空气中的________________。
假设3:可能是氢氧化镁的溶解度随温度的降低而________________。
由碱的性质可知,假设1不成立。
[实验探究]
实验操作 | 实验现象 | 结论 |
1.取上述红色溶液,保持温度不变,在空气中放置一段时间,观察现象。 | ①______ | 假设2成立 |
2.取上述红色溶液,②________,③__________观察现象。 | 红色褪去 | 假设3成立 |
[拓展延伸]
(1)将一小块金属钠投入硫酸铜溶液时,产生蓝色沉淀。分析原因是其中发生了两步化学反应:.①![]() ,②______(请写出该步反应的化学方程式)。
,②______(请写出该步反应的化学方程式)。
(2)除上述金属外,根据金属活动性顺序,预测_________也能跟硫酸铜溶液反应产生上述现象(举一例即可)。
【题目】小明同学对家中久置的袋装固体食品防腐剂的成分产生了兴趣(品名和成分如图所示),于是和同学一起,设计实验进行探究:

[提出问题]久置固体食品防腐剂的成分是什么?
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3 。
[实验探究]甲同学的探究方案如下表:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有_____和氢氧化钙。此过程的化学方程式_____。 |
(2)另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有Fe,一定不含 Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | _____。 | 固体中一定含有CaCO3 |
[交流与反思]
(1)“504双吸剂”中的铁粉可以吸收空气中的_____、_____。
(2)实验操作(2)的实验现象里“有大量无色气体产生”,根据甲同学的整体探究方案推测,无色气体的成分应当是_____、_____。
(3)小明同学认为久置固体食品防腐剂中是否含Fe还可以用_____检验。
(4)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是_____。
(5)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_____。