题目内容
现有NaNO3和NaCl的混合物10克,完全溶于水配成30克溶液,然后向其中滴加AgNO3溶液至不再产生沉淀时,共加入AgNO3溶液10克,将产生的沉淀过滤、干燥,称得质量为2.87克.求:(1)原混合物中NaNO3的质量分数?(2)将上述滤液蒸发掉多少克水时才能恰好成为t℃时NaNO3的饱和溶液?(t℃时,NaNO3的溶解度为80.0克)
解:(1)设原混合物中NaCl的质量为a,生成NaNO3为b.
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5 85
a 2.87g b
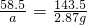
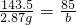
a=1.17g b=1.7g
原混合物中NaNO3的质量分数=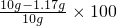 %=88.3%
%=88.3%
(2)滤液中NaNO3的质量=10g-1.17g+1.7g=10.53g
滤液的质量=30g+10g-2.87g=37.13g
t℃时硝酸钠的饱和溶液中溶质的质量分数=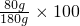 %=44.4%
%=44.4%
设需要蒸发的水的质量为x
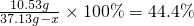
x=13.4g
答:(1)原混合物中硝酸钠的质量分数为88.3%.
(2)需要蒸发的水的质量为13.4g.
分析:(1)利用氯化钠与硝酸银反应的化学方程式,根据氯化银沉淀的质量求出氯化钠的质量,进而求出硝酸钠的质量,最后根据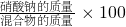 %求出混合物中硝酸钠的质量分数.
%求出混合物中硝酸钠的质量分数.
(2)先求出滤液的质量和滤液中硝酸钠的质量,再求出t℃时硝酸钠的饱和溶液中溶质的质量分数,最后根据蒸发前后溶液中溶质的质量相等列出等式.
点评:本道题的难点是第二小题,不管是稀释溶液还是蒸发溶液,稀释前后或蒸发前后溶质的质量都相等.
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5 85
a 2.87g b
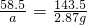
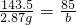
a=1.17g b=1.7g
原混合物中NaNO3的质量分数=
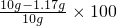 %=88.3%
%=88.3%(2)滤液中NaNO3的质量=10g-1.17g+1.7g=10.53g
滤液的质量=30g+10g-2.87g=37.13g
t℃时硝酸钠的饱和溶液中溶质的质量分数=
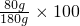 %=44.4%
%=44.4%设需要蒸发的水的质量为x
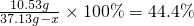
x=13.4g
答:(1)原混合物中硝酸钠的质量分数为88.3%.
(2)需要蒸发的水的质量为13.4g.
分析:(1)利用氯化钠与硝酸银反应的化学方程式,根据氯化银沉淀的质量求出氯化钠的质量,进而求出硝酸钠的质量,最后根据
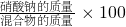 %求出混合物中硝酸钠的质量分数.
%求出混合物中硝酸钠的质量分数.(2)先求出滤液的质量和滤液中硝酸钠的质量,再求出t℃时硝酸钠的饱和溶液中溶质的质量分数,最后根据蒸发前后溶液中溶质的质量相等列出等式.
点评:本道题的难点是第二小题,不管是稀释溶液还是蒸发溶液,稀释前后或蒸发前后溶质的质量都相等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目