题目内容
在试管中高温加热镁粉与氧化铜粉末的混合物,充分发生置换反应后,为了确定反应后试管中固体物质的成分,请你提出固体物质组成的所有可能猜想,并设计简单、易行的实验方案,证明你的猜想.
(1)提出猜想:固体物质的组成可能是:①________、②________、③________.
(2)实验设计与探究:
| 实验操作 | 现 象 | 结 论 |
| ________ | ________ | 猜想①成立 |
| ________ | ________ | 猜想②成立 |
| ________ | ________ | 猜想③成立 |
(2)实验设计与探究:铜不和盐酸反应;氧化铜和盐酸反应生成氯化铜和水,溶液呈蓝色;镁和稀盐酸反应有氢气放出;
取少量固体物质于试管中,加入足量稀盐酸,固体不溶解,溶液呈无色,固体物质为:铜和氧化镁;
取少量固体物质于试管中,加入足量稀盐酸,固体部分溶解,溶液呈蓝色,固体物质为:铜、氧化镁和氧化铜;
取少量固体物质于试管中,加入足量稀盐酸,固体部分溶解,有气体产生,溶液呈无色,固体物质为:铜、镁粉和氧化镁;
故答案为:(1)①铜 和氧化镁; ②铜、氧化镁和氧化铜; ③铜、镁粉和氧化镁;
(2)
| 实验操作 | 现 象 | 结 论 |
| 取少量固体物质于试管中,加入足量稀盐酸 | 固体不溶解,溶液呈无色 | 猜想①成立 |
| 取少量固体物质于试管中,加入足量稀盐酸 | 固体部分溶解,溶液呈蓝色 | 猜想②成立 |
| 取少量固体物质于试管中,加入足量稀盐酸 | 固体部分溶解,有气体产生,溶液呈无色 | 猜想③成立 |
分析:(1)根据镁和氧化铜反应生成铜和氧化镁以及镁和氧化铜的量进行猜想;
(2)根据铜不和盐酸反应、氧化铜和盐酸反应生成氯化铜和水,溶液呈蓝色以及镁和稀盐酸反应有氢气放出进行解答.
点评:关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.本考点主要出现在实验题中.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案(1)提出猜想:固体物质的组成可能是:①______、②______、③______.
(2)实验设计与探究:
| 实验操作 | 现 象 | 结 论 |
| ______ | ______ | 猜想①成立 |
| ______ | ______ | 猜想②成立 |
| ______ | ______ | 猜想③成立 |
碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成。
(1)提出问题: 黑色固体是什么?
(2)猜想与假设: 黑色固体可能是:① ;②可能是炭粉;③可能是炭粉和氧化铜的混合物。请你补充猜想①。作出这些猜想的依据是 。
(3)实验方案: 他们称取了2.22g碱式碳酸铜在试管中高温加热使之完全分解,冷却至室温,称得黑色固体产物的质量为1.6g。
(4)实验反思:① 甲同学经过思考后,认为可以排除猜想③,理由是 (用化学方程式表示)。
② 乙同学根据质量守恒定律:化学反应前后,元素的种类和质量都不变。通过对得到的数据进行计算,排除了猜想②,他的理由是(通过计算式说明) 。
(5)实验结论:结合甲、乙同学的探究和查阅资料,丙同学确认只有猜想①成立。
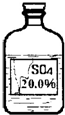
(6)实验拓展:丙同学想进一步探究该黑色固体的化学性质。他发现实验室有一瓶无色溶液,其标签严重破损(如图),
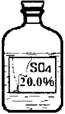
老师告诉他该瓶试剂是硫酸、硫酸钠或硫酸镁溶液中的一种。他通过查阅资料得知常温下这三种物质的溶解度如下表:
|
物 质 |
H2SO4 |
Na2SO4 |
MgSO4 |
|
常温下的溶解度∕g |
与水以任意比互溶 |
18.0 |
39.0 |
丙同学根据以上信息,分析此溶液一定不是 溶液。为确定其成分,他取了少量黑色固体放入试管中,然后向其中滴加了一定量的该无色溶液后,发现黑色固体全部消失,溶液由无色变为蓝色。他确定该溶液为 。其反应的化学方程式为 。
【解析】初中阶段常见的黑色物质有:氧化铜、碳、二氧化锰、四氧化三铁等.然后根据化学反应前后元素种类不变,进行分析确定物质组成,(4)①碳具有还原性,能够和金属氧化物发生氧化还原反应,所以碳和氧化铜不能同时存在,②2.22g碱式碳酸铜含碳元素的质量为12/222×22.2g=0.12g≠1.6g,
(6)由标签可知:溶液的质量分数是20%,题中给出三种物种的溶解度,根据溶解度计算,在该温度下,饱和溶液中的溶质的质量分数,分析不可能的是什么.可能是什么;硫酸铜溶液是蓝色的
 碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成.
碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成.