题目内容
 碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成.
碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成.(1)提出问题:黑色固体是什么?
(2)猜想与假设:黑色固体可能是:①
可能是氧化铜
可能是氧化铜
;②可能是炭粉;③可能是炭粉和氧化铜的混合物.请你补充猜想①.作出这些猜想的依据是化学反应前后元素种类不变,且氧化铜和炭粉都是黑色固体
化学反应前后元素种类不变,且氧化铜和炭粉都是黑色固体
.(3)实验方案:他们称取了2.22g碱式碳酸铜在试管中高温加热使之完全分解,冷却至室温,称得黑色固体产物的质量为1.6g.
(4)实验反思:①甲同学经过思考后,认为可以排除猜想③,理由是
C+2CuO
Cu+CO2↑
| ||
C+2CuO
Cu+CO2↑
(用化学方程式表示).
| ||
②乙同学根据质量守恒定律:化学反应前后,元素的种类和质量都不变.通过对得到的数据进行计算,排除了猜想②,他的理由是(通过计算式说明)
2.22g碱式碳酸铜含碳元素的质量为
×22.2g=1.2g≠1.6g
| 12 |
| 222 |
2.22g碱式碳酸铜含碳元素的质量为
×22.2g=1.2g≠1.6g
.| 12 |
| 222 |
(5)实验结论:结合甲、乙同学的探究和查阅资料,丙同学确认只有猜想①成立.
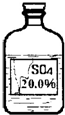
(6)实验拓展:丙同学想进一步探究该黑色固体的化学性质.他发现实验室有一瓶无色溶液,其标签严重破损(如图),老师告诉他该瓶试剂是硫酸、硫酸钠或硫酸镁溶液中的一种.他通过查阅资料得知常温下这三种物质的溶解度如下表:
| 物 质 | H2SO4 | Na2SO4 | MgSO4 |
| 常温下的溶解度∕g | 与水以任意比互溶 | 18.0 | 39.0 |
硫酸钠
硫酸钠
溶液.为确定其成分,他取了少量黑色固体放入试管中,然后向其中滴加了一定量的该无色溶液后,发现黑色固体全部消失,溶液由无色变为蓝色.他确定该溶液为硫酸
硫酸
.其反应的化学方程式为H2SO4+CuO═CuSO4+H2O
H2SO4+CuO═CuSO4+H2O
.分析:(2)探究性题目的做法是大胆推测,但要有合理的依据,不能凭空猜想;根据质量守恒定律可知,碱式碳酸铜的产物是有Cu、O、H、C中的一种或多种元素组合而成;根据题目信息(黑色粉末)可知,黑色物质还可能是氧化铜;
(4)①根据氧化铜、碳高温可相互反应分析解答;
②利用质量守恒定律元素的质量守恒解答即可;
(6)由标签可知:溶液的质量分数是20%,题中给出三种物质的溶解度,根据溶解度计算在该温度下,饱和溶液中的溶质的质量分数,从而可以确定溶液的可能组成;
能与氧化铜发生反应的是硫酸,生成硫酸铜和水.
(4)①根据氧化铜、碳高温可相互反应分析解答;
②利用质量守恒定律元素的质量守恒解答即可;
(6)由标签可知:溶液的质量分数是20%,题中给出三种物质的溶解度,根据溶解度计算在该温度下,饱和溶液中的溶质的质量分数,从而可以确定溶液的可能组成;
能与氧化铜发生反应的是硫酸,生成硫酸铜和水.
解答:解:
(2)根据质量守恒定律可知,反应前后元素的种类不变;碱式碳酸铜Cu2(OH)2CO3的产物是有Cu、O、H、C中的一种或多种元素组合而成;结合题目信息(黑色粉末)可知,氧化铜和碳都是黑色固体;所以黑色物质还可能是氧化铜;
(4)①因为该反应在高温下进行,而碳和氧化铜在高温下可相互反应生成铜和二氧化碳,方程式是C+2CuO
Cu+CO2↑,所以不可能是二者的混合物,可以排除猜想③;
②2.22g碱式碳酸铜含碳元素的质量为
×22.2g=1.2g≠1.6g,所以不可能是碳,排除了猜想②;
(6)硫酸的溶解度是能与水以任意比互溶,溶液中溶质的质量分数可以达到20%,可能是硫酸;
根据硫酸钠的溶解度,在该温度下,硫酸钠饱和溶液的溶质的质量分数为:
×100%≈17%,即最大质量分数不会超过17%,而图中信息为20%,则一定不是硫酸钠溶液;
根据硫酸镁的溶解度,在该温度下,硫酸镁饱和溶液的溶质的质量分数是:
×100%≈28.06%,即最大质量分数不会超过28.06%,可能是硫酸镁;
氧化铜与硫酸镁不反应,故不可能是硫酸镁;与氧化铜发生反应的是硫酸,生成硫酸铜和水,方程式是 H2SO4+CuO═CuSO4+H2O;
故答案为:
(2)①可能是氧化铜; 化学反应前后元素种类不变,且氧化铜和炭粉都是黑色固体;
(4)①C+2CuO
Cu+CO2↑;
②2.22g碱式碳酸铜含碳元素的质量为
×22.2g=1.2g≠1.6g;
(6)硫酸钠; 硫酸; H2SO4+CuO═CuSO4+H2O.
(2)根据质量守恒定律可知,反应前后元素的种类不变;碱式碳酸铜Cu2(OH)2CO3的产物是有Cu、O、H、C中的一种或多种元素组合而成;结合题目信息(黑色粉末)可知,氧化铜和碳都是黑色固体;所以黑色物质还可能是氧化铜;
(4)①因为该反应在高温下进行,而碳和氧化铜在高温下可相互反应生成铜和二氧化碳,方程式是C+2CuO
| ||
②2.22g碱式碳酸铜含碳元素的质量为
| 12 |
| 222 |
(6)硫酸的溶解度是能与水以任意比互溶,溶液中溶质的质量分数可以达到20%,可能是硫酸;
根据硫酸钠的溶解度,在该温度下,硫酸钠饱和溶液的溶质的质量分数为:
| 19.0g |
| 100g+19.0g |
根据硫酸镁的溶解度,在该温度下,硫酸镁饱和溶液的溶质的质量分数是:
| 39.0g |
| 100+39.0g |
氧化铜与硫酸镁不反应,故不可能是硫酸镁;与氧化铜发生反应的是硫酸,生成硫酸铜和水,方程式是 H2SO4+CuO═CuSO4+H2O;
故答案为:
(2)①可能是氧化铜; 化学反应前后元素种类不变,且氧化铜和炭粉都是黑色固体;
(4)①C+2CuO
| ||
②2.22g碱式碳酸铜含碳元素的质量为
| 12 |
| 222 |
(6)硫酸钠; 硫酸; H2SO4+CuO═CuSO4+H2O.
点评:本题主要考查了利用所学知识,通过实验探究碱式碳酸铜的受热分解产物,其中涉及到质量守恒定律的应用,依据碳和氧化铜的化学性质不同,选择合适的试剂并根据实验现象对二者进行鉴别等问题,该类实验探究题能很好的考查学生的分析、解决问题的能力,并培养学生的思维能力.

练习册系列答案
相关题目
 2009年2月法国欲拍卖我圆明园兔首和鼠首两件文物(如图).
2009年2月法国欲拍卖我圆明园兔首和鼠首两件文物(如图). (1)课外活动小组的同学为了探究实验室的一种黑色粉末和一瓶标签破损的无色溶液(如右图)可能是什么物质,大胆猜想并设计实验进行验证,请你参与他们的探究.
(1)课外活动小组的同学为了探究实验室的一种黑色粉末和一瓶标签破损的无色溶液(如右图)可能是什么物质,大胆猜想并设计实验进行验证,请你参与他们的探究.