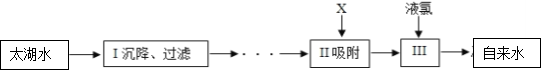
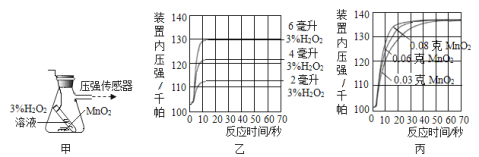
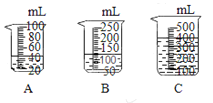
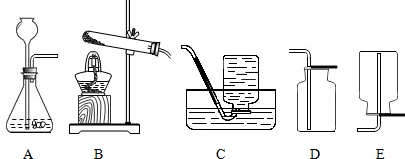
题目内容
【题目】(1分)胃酸过多的人不宜大量食用的是
A.山楂汁(pH:2.1~2.8) B.玉米粥(pH:7.1~8.0)
C.牛奶(pH:6.3~6.6) D.苏打水(pH:8.6~10.2)
【答案】A
【解析】
试题分析:胃酸过多的人不宜大量食用酸性食物A.山楂汁的pH为2.1﹣2.8,呈强酸性,正确;B.玉米粥的pH为7.1﹣8.0,呈弱碱性,可以食用,错误;C.牛奶的pH为6.3﹣6.6,呈弱酸性,不宜食用,错误;D.苏打水的pH为7.1﹣8.0,呈碱性,可以食用,错误。故选A

练习册系列答案
相关题目
【题目】如图是某种薯片的包装袋,里面被一种气体充得鼓鼓的.小明对这种气体产生了兴趣,
请你和小明一起对该气体进行探究.

【提出问题】该气体可能是什么呢?
【查阅资料】食品和氧气接触容易被氧化而腐败;常填充某种气体以防腐.
【作出假设】包装袋中的气体一定不能是_________________
A.二氧化碳 B.氮气 C.空气 D.氧气
【进行实验】同学们进行了进一步探究,请你帮该组同学完善探究过程,具体操作如下:
实验方法 | 可能观察到的现象和结论 |
用注射器抽取包装袋的气体,并将气体注入_______________________中,观察现象。 | _________________________,说明包装袋中装的不是二氧化碳。 |
用排水法继续收集一瓶该包装袋内的气体,并向集气瓶中伸入燃着的小木条,观察现象。 | _______________,说明包装袋中的气体可能是__________。 |
【反思讨论】根据食品防腐气体应具备的要求,你认为包装袋内充的气体还可以是_________。