题目内容
 某学习小组对硫酸进行如下研究:
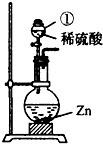
某学习小组对硫酸进行如下研究:(1)图中仪器①的名称为
分液漏斗
分液漏斗
,发生反应的化学方程为Zn+H2SO4 ═ZnSO4+H2↑
Zn+H2SO4 ═ZnSO4+H2↑
;该装置也可用于实验室制取二氧化碳
二氧化碳
气体,化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
.(2)已知相同温度下,硫酸中溶质的质量分数越大,溶液酸 性越强.常温下10%的稀硫酸的pH
<
<
2%的硫酸(填“>”“<”或“=”),若对稀硫酸进行如下操作,溶液的pH因化学变化而升高的有B C
B C
.A.加少量水 B.加少量铁粉 C.加少量氢氧化钾溶液 D.加少量浓硫酸.
分析:(1)实验室制氢气、二氧化碳都可用固液常温型装置,根据书写方程式的原则书写化学方程式
(2)根据题意硫酸浓度越大,酸性越强,根据溶液酸性与pH的关系分析;根据能否发生化学反应以及溶液pH的变化分析
(2)根据题意硫酸浓度越大,酸性越强,根据溶液酸性与pH的关系分析;根据能否发生化学反应以及溶液pH的变化分析
解答:解:(1)仪器名称为分液漏斗,锌与稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4 ═ZnSO4+H2↑
该装置是固液常温型装置,实验室还可用此装置制取二氧化碳,化学方程式为
(2)根据题中信息,相同温度下,硫酸中溶质的质量分数越大,溶液酸性越强,pH越小,故常温下10%的稀硫酸的pH<2%的硫酸;A、稀硫酸中加水溶液pH升高,但此变化是物理变化;B、加铁粉,硫酸与铁反应生成硫酸亚铁和氢气,使溶液的pH增大,正确;C、加少量氢氧化钾,硫酸与氢氧化钾反应生成硫酸钾和水,使溶液pH增大;正确;D、加少量浓硫酸,溶液pH降低,故D错误;故选BC
故答案为:(1)分液漏斗;Zn+H2SO4 ═ZnSO4+H2↑;二氧化碳;CaCO3+2HCl═CaCl2+H2O+CO2↑;(2)<BC
该装置是固液常温型装置,实验室还可用此装置制取二氧化碳,化学方程式为
(2)根据题中信息,相同温度下,硫酸中溶质的质量分数越大,溶液酸性越强,pH越小,故常温下10%的稀硫酸的pH<2%的硫酸;A、稀硫酸中加水溶液pH升高,但此变化是物理变化;B、加铁粉,硫酸与铁反应生成硫酸亚铁和氢气,使溶液的pH增大,正确;C、加少量氢氧化钾,硫酸与氢氧化钾反应生成硫酸钾和水,使溶液pH增大;正确;D、加少量浓硫酸,溶液pH降低,故D错误;故选BC
故答案为:(1)分液漏斗;Zn+H2SO4 ═ZnSO4+H2↑;二氧化碳;CaCO3+2HCl═CaCl2+H2O+CO2↑;(2)<BC
点评:本题考查实验室制取气体的发生装置、化学方程式书写及溶液酸碱性与pH的关系,考查学生运用新信息分析问题的能力.

练习册系列答案
相关题目
 (2011?扬州)某学习小组对硫酸进行如下研究:
(2011?扬州)某学习小组对硫酸进行如下研究: 某学习小组对硫酸进行如下研究:
某学习小组对硫酸进行如下研究: