题目内容
小明希望用稀硫酸和锌粒反应来制取氢气,但实验室提供的是溶质质量分数为98%的浓硫酸.试计算:
(1)将10g浓硫酸配制成溶质质量分数为19.6%的稀硫酸,需要加水多少克?______
(2)取上述配制好的溶质质量分数为19.6%的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少克?______
(3)充分反应后所得溶液中溶质的质量分数是多少?______.
解:(1)解:设加水的质量为x.
10g×98%=(10g+x)×19.6%
x=40g
(2)解:设生成氢气的质量为y,生成ZnSO4的质量为z.
Zn+H2SO4═ZnSO4+H2↑
98 161 2
20g×19.6% z y
 =
=
y=0.08g
(3)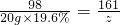
z=6.44g
充分反应后所得溶液的质量=20g×(1-19.6%)+6.44g=22.52g
反应后所得溶液中溶质的质量分数=
故答案为:(1)40g(2)0.08g(3)28.6%
分析:由于溶液中溶质的质量分数=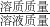 ×100%,则溶液质量=
×100%,则溶液质量=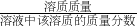 ,溶质质量=溶液质量×溶液中溶质的质量分数;根据化学方程式计算代入的数据必须是纯物质的质量.
,溶质质量=溶液质量×溶液中溶质的质量分数;根据化学方程式计算代入的数据必须是纯物质的质量.
(1)由于用水稀释浓溶液成稀溶液的过程中,溶质的质量不变,稀溶液与浓溶液质量之差就是加入水的质量.
(2)由于20g稀硫酸中溶质的质量可以求出,因此根据硫酸的质量就可以求出生成的氢气的质量.
(3)得到充分反应后所得溶液的质量,依据溶液中溶质的质量分数=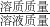 ×100%即可求得.
×100%即可求得.
点评:本题难度不是很大,主要考查了有关溶质质量分数的计算及根据化学方程式进行有关量的计算,培养学生的计算能力和应用知识分析问题、解决问题的能力.
10g×98%=(10g+x)×19.6%
x=40g
(2)解:设生成氢气的质量为y,生成ZnSO4的质量为z.
Zn+H2SO4═ZnSO4+H2↑
98 161 2
20g×19.6% z y
 =
=
y=0.08g
(3)
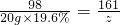
z=6.44g
充分反应后所得溶液的质量=20g×(1-19.6%)+6.44g=22.52g
反应后所得溶液中溶质的质量分数=

故答案为:(1)40g(2)0.08g(3)28.6%
分析:由于溶液中溶质的质量分数=
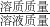 ×100%,则溶液质量=
×100%,则溶液质量=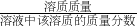 ,溶质质量=溶液质量×溶液中溶质的质量分数;根据化学方程式计算代入的数据必须是纯物质的质量.
,溶质质量=溶液质量×溶液中溶质的质量分数;根据化学方程式计算代入的数据必须是纯物质的质量.(1)由于用水稀释浓溶液成稀溶液的过程中,溶质的质量不变,稀溶液与浓溶液质量之差就是加入水的质量.
(2)由于20g稀硫酸中溶质的质量可以求出,因此根据硫酸的质量就可以求出生成的氢气的质量.
(3)得到充分反应后所得溶液的质量,依据溶液中溶质的质量分数=
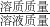 ×100%即可求得.
×100%即可求得.点评:本题难度不是很大,主要考查了有关溶质质量分数的计算及根据化学方程式进行有关量的计算,培养学生的计算能力和应用知识分析问题、解决问题的能力.

练习册系列答案
相关题目