题目内容
(7分)小明希望用稀硫酸和锌粒反应来制取氢气,但实验室提供的是溶质质量分数为98%的浓硫酸。试计算:⑴ 将10 g浓硫酸配制成溶质质量分数为19.6%的稀硫酸,需要加水多少克?
⑵ 取上述配制好的溶质质量分数为19.6%的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少克?
⑶ 充分反应后所得溶液中溶质的质量分数是多少?
⑴解:设加水的质量为x。
10 g×98%=(10g+x)×19.6% ………1分
x ="40" g ………1分
⑵解:设生成氢气的质量为y,生成ZnSO4的质量为z。
Zn + H2SO4= ZnSO4+ H2↑ ………1分
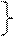 98 161 2
98 161 2
20 g×19.6% z y ………1分
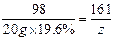 y=0.08 g ………1分
y=0.08 g ………1分
⑶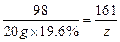 z=6.44 g ………1分
z=6.44 g ………1分
充分反应后所得溶液的质量=20 g×(1-19.6%)+6.44 g=22.52 g
反应后所得溶液中溶质的质量分数=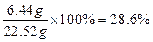 ………1分
………1分
【说明:其它解答,所得溶液质量=参加反应锌质量+稀硫酸质量20g-放出H2质量。求出溶质质量和溶液中溶质的质量分数各得1分;如溶液质量不是22.52g,而是22.6g(未减去H2质量),虽最终结果相差无几,但思路计算式错误,扣最后1分】
答:略。【说明:设、答齐全共1分,缺一项不得分。其它合理解答,也可分步得分解析:
略
10 g×98%=(10g+x)×19.6% ………1分
x ="40" g ………1分
⑵解:设生成氢气的质量为y,生成ZnSO4的质量为z。
Zn + H2SO4= ZnSO4+ H2↑ ………1分
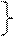 98 161 2
98 161 220 g×19.6% z y ………1分
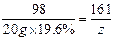 y=0.08 g ………1分
y=0.08 g ………1分⑶
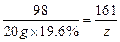 z=6.44 g ………1分
z=6.44 g ………1分充分反应后所得溶液的质量=20 g×(1-19.6%)+6.44 g=22.52 g
反应后所得溶液中溶质的质量分数=
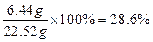 ………1分
………1分【说明:其它解答,所得溶液质量=参加反应锌质量+稀硫酸质量20g-放出H2质量。求出溶质质量和溶液中溶质的质量分数各得1分;如溶液质量不是22.52g,而是22.6g(未减去H2质量),虽最终结果相差无几,但思路计算式错误,扣最后1分】
答:略。【说明:设、答齐全共1分,缺一项不得分。其它合理解答,也可分步得分解析:
略

练习册系列答案
相关题目