题目内容
某同学对某地工业废水(含有硫酸和盐酸)中的H2SO4 进行测定.取50g该废水于烧杯中,加入足量的BaCl2溶液,充分反应中,过滤、洗涤、干燥得到BaSO4固体11.65g.求50g该废水中H2SO4 的质量.
解:设50g废水中硫酸的质量为x.
H2SO4+BaCl2=BaSO4↓+2HCl
98 233
x 11.65g
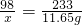
x=4.9g
答:50g该废水中H2SO4 的质量是4.9g.
分析:根据硫酸与氯化钡反应的化学方程式由沉淀的质量可以计算出废水中硫酸的质量;
点评:本题考查有关化学方程式的计算,难度不大,主要是利用方程式中已知物质的质量求出未知物质的质量;
H2SO4+BaCl2=BaSO4↓+2HCl
98 233
x 11.65g
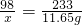
x=4.9g
答:50g该废水中H2SO4 的质量是4.9g.
分析:根据硫酸与氯化钡反应的化学方程式由沉淀的质量可以计算出废水中硫酸的质量;
点评:本题考查有关化学方程式的计算,难度不大,主要是利用方程式中已知物质的质量求出未知物质的质量;

练习册系列答案
相关题目