题目内容
【题目】(11分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙为原料(含量为97.5%,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下:
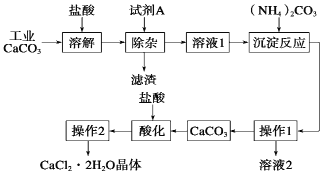
(1)除杂操作时加入试剂A,调节溶液的pH为8.0~8.5,以除去溶液中少量的Al3+、Fe3+。试剂A是Ca(OH)2,还可以选择 。
a.NaOH b.NH3 c.Na2CO3
(2)请指出下列操作的名称:操作1 ;操作2蒸发浓缩、 ;操作1中所用的玻璃仪器有漏斗、玻璃棒、 。
(3)酸化操作是加入过量盐酸,调节溶液的pH为4.0,目的之一是为了将少量的 转化为CaCl2。
(4)写出加入碳酸铵所发生的反应的方程式: +(NH4)2CO3=CaCO3↓+2NH4Cl
写出溶液2的一种用途 。
(5)测定样制得品中Cl-含量的方法是:称1.5g样品,溶解,滴加过量的 AgNO3 溶液,过滤、洗涤、干燥,称得沉淀质量为2.87g,证明沉淀洗净的标准是:取最后一次洗涤的滤液,滴加 试剂,若 现象,则已经洗净。
(6)计算上述样品中CaCl2·2H2O的质量分数为: 。若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: 。
【答案】(1)b (2)过滤 降温结晶 烧杯
(3)Ca(OH)2 (4)CaCl2 作氮肥
(5)NaCl(或者Na2CO3) 无明显现象
(6)98% 样品中有少量氯化钠(或少量晶体失水)
【解析】
试题分析:(1)除杂操作时加入试剂A,调节溶液的pH为8.0~8.5(溶液显弱碱性),以除去溶液中少量的Al3+、Fe3+,故应选NH3,显弱碱性
(2)操作1是将CaCO3和液体分离开,故名称是:过滤;操作2是从CaCl2溶液中得到氯化钙晶体,故步骤为:蒸发浓缩、降温结晶;操作1中所用的玻璃仪器有漏斗、玻璃棒、烧杯
(3)酸化操作是加入过量盐酸,调节溶液的pH为4.0,目的之一是为了将少量的Ca(OH)2转化为CaCl2
(4)根据质量守恒定律以及复分解反应的特征,可推出空格中的物质为:CaCl2;溶液2中的溶质为:NH4Cl,它的一种用途:作氮肥
(5)证明沉淀洗净的标准是:取最后一次洗涤的滤液,滴加NaCl(或者Na2CO3);若无明显现象,则已经洗净
(6)根据质量守恒定律:化学反应前后,元素的质量不变,即样品中氯元素的质量=沉淀AgCl中氯元素的质量,故可设样品中CaCl2·2H2O的质量为x,列式为:x×71/147×100%=2.87g×35.5/143.5×100%,x=1.47g,故样品中CaCl2·2H2O的质量分数=1.47g/1.5g×100%=98%;若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高,其可能原因有:样品中有少量氯化钠(或少量晶体失水)

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案