题目内容
(2010?鞍山)我国钢铁产量居全球第一,占全球总产量的30%以上.某兴趣小组到钢铁厂做社会调查,取钢样(假设只含铁和碳)进行实验.他们向组成完全相同的四份钢样粉末中分别加入100g稀H2SO4溶液,充分反应后,测得的实验数据如下表所示:| 实验l | 实验2 | 实验3 | 实验4 | |
| 钢样粉末质量 | 2.84g | 4.26g | 6.23g | 7.5lg |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
【答案】分析:根据上述实验可知100g稀硫酸最多可产生0.2g氢气,利用铁和硫酸反应的化学方程式,根据氢气的质量求出参加反应的铁的质量,根据氢气的质量求出反应后所得溶液中的溶质硫酸亚铁的质量,用铁的质量+稀硫酸的质量-氢气的质量求出反应后所得溶液的质量,最后根据 %求出反应后溶液中溶质的质量分数.
%求出反应后溶液中溶质的质量分数.
解答:解:设参加反应的铁的质量为x,生成硫酸亚铁的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.2g
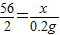
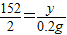
x=5.6g y=15.2g
反应后所得溶液中溶质的质量分数=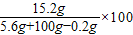 %=14.4%
%=14.4%
答:反应后所得溶液中溶质的质量分数为14.4%.
点评:本道题的实验会将部分学生带入误区,误以为要根据实验三或实验四进行计算,其实我们只需要知道100克稀硫酸完全反应会生成多少克氢气,至于铁的质量需要通过计算才能知道,从实验中是看不出来的.
 %求出反应后溶液中溶质的质量分数.
%求出反应后溶液中溶质的质量分数.解答:解:设参加反应的铁的质量为x,生成硫酸亚铁的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.2g
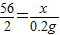
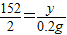
x=5.6g y=15.2g
反应后所得溶液中溶质的质量分数=
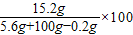 %=14.4%
%=14.4%答:反应后所得溶液中溶质的质量分数为14.4%.
点评:本道题的实验会将部分学生带入误区,误以为要根据实验三或实验四进行计算,其实我们只需要知道100克稀硫酸完全反应会生成多少克氢气,至于铁的质量需要通过计算才能知道,从实验中是看不出来的.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
 (2010?鞍山)小明同学绘制了如图所示A、B两种固体物质的溶液度曲线:
(2010?鞍山)小明同学绘制了如图所示A、B两种固体物质的溶液度曲线:
