题目内容
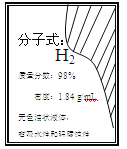
【题目】为了测定液化气中丙烷(![]() )在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | 丙烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 4.4 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
下列判断正确的是
A.表中a的值为5.6 B.X可能是该反应的催化剂
C.X可能含有氢元素 D.X只含碳元素
【答案】A
【解析】
试题分析:A.根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,则可求出a的质量=4.4+12.8-7.2-4.4=5.6,故A正确;
B.X在反应前质量为0,而反应后质量为5.6克,则不符合催化剂的特点“只改变反应速率,而本身的质量和化学性质都不变”,故X一定不是该反应的催化剂;
C.根据质量守恒定律,反应前后元素的质量不变,可求4.4克丙烷(![]() )中氢元素的质量=4.4g×
)中氢元素的质量=4.4g×![]() =0.8g,再求水中氢元素的质量=7.2g×
=0.8g,再求水中氢元素的质量=7.2g×![]() =0.8g,故X中不含有氢元素;
=0.8g,故X中不含有氢元素;
D、根据化学方程式计算,可求:4.4克丙烷(![]() )中碳元素的质量=4.4g-0.8g=3.6g,二氧化碳中碳元素的质量=4.4g×
)中碳元素的质量=4.4g-0.8g=3.6g,二氧化碳中碳元素的质量=4.4g×![]() =1.2g,a中含有的碳元素是3.6g-1.2g=2.4g,而a的质量的5.6g,则a中一定会含有氧元素;
=1.2g,a中含有的碳元素是3.6g-1.2g=2.4g,而a的质量的5.6g,则a中一定会含有氧元素;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目