题目内容
在由CH4和H2组成的混合气体中,测知碳元素的质量分数为60%,则混合气体充分燃烧生成二氧化碳和水的质量比为
- A.11:18
- B.22:9
- C.1:1
- D.11:27
A
分析:假设混合气体中CH4和H2的质量分别为x,y,依据混合气体中碳元素的质量分数列出比例式,进行解答.然后利用质量守恒定律分别求出二氧化碳和水的质量.
解答:设混合气体中CH4质量为x,H2的质量为 y,可得
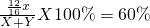
解得x:y=4:1
则气体中C、H元素质量比为:(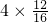 ):(
):(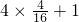 )=3:2
)=3:2
其中C、H原子个数比=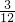 :
: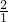 =1:8;所以二氧化碳和水的分子个数比为
=1:8;所以二氧化碳和水的分子个数比为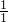 :
: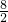 =1:4,二氧化碳和水的质量比为(1×44):(4×18)=11:18
=1:4,二氧化碳和水的质量比为(1×44):(4×18)=11:18
故选A
点评:本题考查学生根据物质中元素的质量百分数进行分析解题的能力.
分析:假设混合气体中CH4和H2的质量分别为x,y,依据混合气体中碳元素的质量分数列出比例式,进行解答.然后利用质量守恒定律分别求出二氧化碳和水的质量.
解答:设混合气体中CH4质量为x,H2的质量为 y,可得
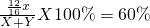
解得x:y=4:1
则气体中C、H元素质量比为:(
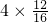 ):(
):(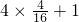 )=3:2
)=3:2其中C、H原子个数比=
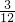 :
: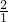 =1:8;所以二氧化碳和水的分子个数比为
=1:8;所以二氧化碳和水的分子个数比为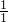 :
: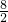 =1:4,二氧化碳和水的质量比为(1×44):(4×18)=11:18
=1:4,二氧化碳和水的质量比为(1×44):(4×18)=11:18故选A
点评:本题考查学生根据物质中元素的质量百分数进行分析解题的能力.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
在由CH4和H2组成的混合气体中,测知碳元素的质量分数为60%,则混合气体充分燃烧生成二氧化碳和水的质量比为( )
| A、11:18 | B、22:9 | C、1:1 | D、11:27 |