题目内容
某化学兴趣小组对某假黄金
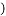


(1)铜锌合金中,锌的质量是______。
(2)所用稀硫酸中溶质的质量分数是多少___________?
下列除去杂质的方法中,正确的是( )
选项 | 括号内为杂质 | 方 法 |
A | CO2(CO) | 点燃 |
B | CaCl2溶液(HCl) | 加入过量的CaCO3,充分反应后过滤 |
C | NaOH溶液(Na2CO3) | 加入适量的盐酸 |
D | Fe(Cu) | 加入足量的稀硫酸,充分反应后过滤 |
A. A B. B C. C D. D
以菱锌矿(主要成分是ZnCO3,杂质为Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
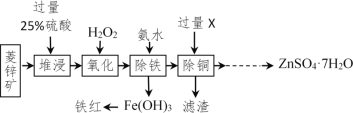
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是_____________________;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸质量为_____g(列出算式即可),需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和________,此处玻璃棒的作用是____ ;
(3)物质X是___________,除铜时发生的反应属于________________反应(填基本反应类型);
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式:_______________。
(5)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶、过滤、洗涤和低温烘干;
(6)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
编号 | 反应温度/℃ | 溶液pH | 除铁率/% |
a | 30 | 2 | 91.5 |
b | 30 | 2.5 | 93.3 |
c | 40 | 2.5 | 95.1 |
d | 40 | 3.1 | Y |
e | 50 | 3.1 | 99.5 |
①实验____和实验_____对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;
②实验a和实验b对比,得到结论是____________;
③表中Y的值可能为_____________(填编号)
A 93.4 B 94.1 C 97.8 D 99.6
④最佳的除铁条件为反应温度______℃,溶液pH_________。
硬铝属于铝合金,因为具有密度较小、强度较大、耐腐蚀性较强等特点,所以是制造飞机和宇宙飞船的理想材料。已知硬铝粉末除铝外,还含有镁、铜中的一种或两种。某化学兴趣小组在老师的指导下,对硬铝粉末中镁、铜的存在情况进行了探究。
查阅资料:铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑(产物NaAlO2溶于水);Mg、Cu不与氢氧化钠溶液反应。
(提出猜想)
猜想1:该合金粉末中除Al外,还含有Mg。
猜想2:该合金粉末中除Al外,还含有Cu。
猜想3:该合金粉末中除Al外,还含有_____(填化学式)。
(实验探究)下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液。
实验方案 | 实现现象 | 结论 |
①取一定量的硬铝粉末,加过量的_____,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 硬铝中一定含有_____。 |
②取步骤①所得滤渣,加过量的_____,充分反应。 | 滤渣部分溶解,并有气体放出。 | 硬铝中一定含有_____。 |
(得出结论):猜想_____成立。
附加题:若正确回答下列小题,将获得4分的奖励,但化学试卷总分不超过60分。
(拓展与分析)请设计两个不同的实验方案,验证铝、铜的金属活动性强弱。
方案一:_____;
方案二:_____。


 拣尖 B.
拣尖 B.  摊放
摊放 杀青 D.
杀青 D.  烘干
烘干